
35.(7分)取50.0毫升Na2CO3和Na2SO4的混和溶液,加入过量BaCI2溶液后得到14.51克白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66克,并有气体放出.试计算:
(1)原混和溶液中Na2CO3和Na2SO4的摩尔浓度;
(2)产生的气体在标准状况下的体积.
34.(6分)有机化合物A、B分子式不同,它们只可能含碳、氢、氧元素中的两种或三种.如果将A、B不论以何种比例混和,只要其物质的量之和不变,完全燃烧时所消耗的氧气和生成的水的物质的量也不变.那么,A、B组成必须满足的条件是 .若A是甲烷,则符合上述条件的化合物B中,分子量最小的是(写出分子式) ,并写出分子量最小的含有甲基(-CH3)的B的2种同分异构体结构简式:
33.(6分)下页图中①-⑧都是含有苯环的化合物.在化合物③中,由于氯原子在硝基的邻位上,因而反应性增强,容易和反应试剂中跟氧原子相连的氢原子相结合,从而消去HCl.
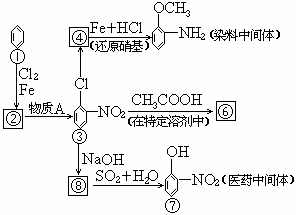
请写出图中由化合物③变成化合物④、由化合物③变成化合物⑥、由化合物⑧变成化合物⑦的化学方程式(不必注明反应条件,但是要配平).
③→④
③→⑥
⑧→⑦
32.(6分)碳正离子(例如,CH3+,CH5+,(CH3)3C+等)是有机反应中重要的中间体。欧拉(G.Olah)因在此领域研究中的卓越成就而荣获1994年诺贝尔化学奖。
碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到,而CH5+失去H2可得CH3+。
(1)CH3+是反应性很强的正离子,是缺电子的,其电子式是___________
(2)CH3+中4个原子是共平面的,三个键角相等,键角应是___________(填角度)
(3)(CH3)2CH+在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是 .
(4)(CH3)3C+去掉H+后将生成电中性的有机分子,其结构简式是 .
31.(7分)A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系:

据此判断:
(1)在A、B、C这三种化合物中,必定含有乙元素的是 .(用A、B、C字母填写)
(2)单质乙必定是 (填"金属"或"非金属"),其理由是 .
(3)单质乙的分子式可能是 ,则化合物B的分子式是 .
30.(6分)在一定条件下可实现下图所示物质之间的变化:
请填写以下空白:
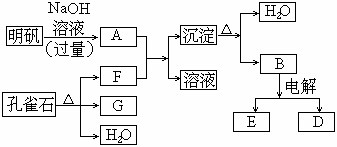
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解.下图中的F是 .
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式: .
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式: .
(4)每生成1摩D,同时生成 摩E.
29.(3分)一氧化氮是大气污染物之一.目前,有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨把一氧化氮还原为氮气和水.请写出该反应的化学方程式 .
28.(9分)实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混和酸,加入反应器中.
②向室温下的混和酸中逐滴加入一定量的苯,充分振荡,混和均匀.
③在50-60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤.
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯.
填写下列空白:
(1)配制一定比例浓硫酸与浓硝酸混和酸时,操作注意事项是: .
(2)步骤③中,为了使反应在50-60℃下进行,常用的方法是 .
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是 .
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是 .
(5)纯硝基苯是无色,密度比水 (填"小"或"大"),具有 气味的油状液体.
27、(6分)图(1)中瓶a内放入20毫升6摩/升盐酸,b是未充气的气球,里边放有4克碳酸钙粉未,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图(1)的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
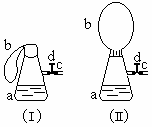
(1)把气球b中的碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ).反应结束后,再次称量,质量为W2克.则W2和W1的关系是 .
(2)取25毫升6摩/升NaOH溶液.先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气).打开d,将溶液挤入瓶中,立即夹紧d.可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失.用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失.使沉淀消失的反应的化学方程式是 .
(3)将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解.此时瓶内温度 (填"不变"、"降低"或"升高").
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状.写出这时发生的反应的化学方程式 .
26.某温度下,在100克水中加入m克CuSO4或加入n克CuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系符合( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com