
13.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其Ph=1,c(Al3+)=0.4 mol·L-1,c(SO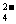 )=0.8 mol·L-1,,则c(K+)为
)=0.8 mol·L-1,,则c(K+)为
A. 0.15 mol·L-1 B.0.2 mol·L-1 C. 0.3 mol·L-1 D.0.4 mol·L-1
12.茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:

关于茉莉醛的下列叙述错误的是
A.、在加热和催化剂作用下,能被氢气还原
B.、能被高锰酸钾酸性溶液氧化
C.、在一定条件下能与溴发生取代反应
D.、不能与氢溴酸发生加成反应
11.在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:
CH3COOH=CH3COO-+H+对于该平衡,下列叙述正确的是
A.、加入水时,平衡向逆反应方向移动
B.、加入少量NaOH固体,平衡向正反应方向移动
C.、加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)
D.、加入少量CH3COONa固体,平衡向正反应方向移动
10.浓度均为0.1 mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是
A.BaCl2 NaOH NaHCO3 B. Na2CO3 MgCl2 H2SO4
C.AlCl3 NH3·H2O NaOH D.Ba(OH)2 CaCl2 Na2SO4
9.把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电
一段时间后,析出钾、镁、铝的物质的量之比为
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
8.NA代表阿伏加德罗常数,下列说法正确的是
A.0.5 mol Al与足量盐酸反应转移电子数为1 NA
B.标准状况下,11.2 L SO3所含的分子数为0.5 NA
C. 0.5 mol CH4所含的电子数为1 NA
D.46 g NO2和N2O4的混合物含有的分子数为1 NA
7.下列叙述正确的是
A、同一主族的元素,原子半径越大,其单质的熔点一定越高
B、同一周期元素的原子,半径越小越容易失去电子
C、同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D、稀有气体元素的原子序数越大,其单质的沸点一定越高
6.在常温常压下呈气态的化合物、降温使其固化得到的晶体属于
A.分子晶体 B.原子晶体
C.离子晶体 D.何种晶体无法判断
25.(10分)利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示
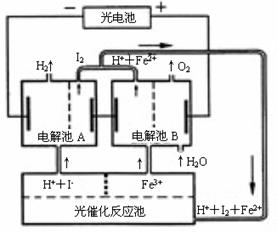
的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
⑴写出电解池A、电解池B和光催化反应池中反应的离子方程式。
⑵若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。
⑶若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
24.(8分)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
⑴CuCl制备过程中需要配置质量分数为20.0%的CuSO4溶液,试计算配置该溶液所需的CuSO4·5H2O与H2O的质量之比。
⑵准确称取所配置的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反化学反应为
Fe3++CuCl===Fe2++Cu2++Cl-
Ce4++Fe2+===Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com