
13.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-4b kJ/mol
B.C2H2(g)+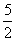 O2(g) 2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g) 2CO2(g)+H2O(l);△H=2b kJ/mol
C.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2b kJ/mol
D.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=b kJ/mol
第Ⅱ卷
12.右图是温度和压强对X+Y = 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
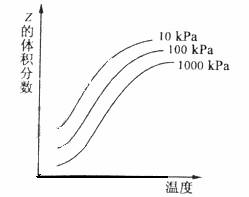
11.关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
10.在pH=1的溶液中,可以大量共存的离子是( )
A.K+、Na+、SO42-、S2O32- B.NH4+、Mg2+、SO42-、Cl-
C.Na+、K+、HCO3-、Cl- D.K+、Na+、AlO2-、NO3-
9.下列说法中正确的是( )
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
8.已知Q与R的摩尔质量之比为9:22,在反应X+2Y=2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量之比为( )
A.46 : 9 B.32 : 9 C.23 : 9 D.16 : 9
7.等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB+VC,则在C的生成物中,该金属元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
6.下列分子中所有原子都满足最外层为8电子结构的是( )
A.BF3 B.H2O C.SiCl4 D.PCl5
35.(8分)海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第______族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是________(填:物理变化或化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐十H2O→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是____________________;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐_________t。(可能需要的相对原子质量:Na 23 Cl 35.5 H 1 O 16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
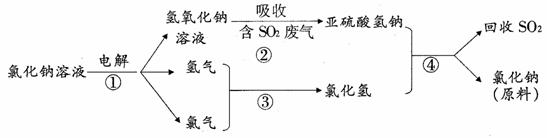
请写出②④的化学反应方程式:_____________________、________________________。
(5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为:HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有________________。(填字母)
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
34.(5分)海洋占地球表面积的71%。据估计,全球生物生产力32%来自海洋生态系统。海洋中的____________是该生态系统重要的生产者,它能够利用太阳能将CO2转化成有机物并释放氧气,这一过程被称为___________,其总化学反应式为:__________________。海洋中还生活着许多动物,如浮游动物、鱼、虾、海鸟等,从生态系统的成分来看,它们被统称为_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com