
6.下列除去杂质的实验方法正确的是
A.除去CO中少量O2:通过灼热的Cu网后再收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤
D.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
5.下列叙述不正确的是
A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
B.乙醇的沸点比甲醚(CH3-O-CH3)高,主要原因是乙醇分子间能形成氢键
C.反应AgCl + NaBr == AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
4.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2 (g) + 1/2O2(g) == H2O (l); △H = -285.8 KJ/mol
CO(g) + 1/2O2(g) == CO2(g); △H = -283 KJ/mol
C8H18 (l) + 25/2O2(g) == 8CO2(g) + 9H2O (l); △H = -5518 KJ/mol
CH4 (g) + 2O2(g) == CO2(g) + 2H2O (l); △H = -890.3 KJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2 (g) B.CO(g) C.C8H18 (l) D.CH4 (g)
3.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3C  2AlN
+ 3CO
2AlN
+ 3CO
下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.上述反应中每生成2molAlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
2.保护环境是每一个公民的责任。下列做法:①推广使用无磷洗涤剂,②城市生活垃圾分类处理,③推广使用一次性木质筷子,④推广使用清洁能源,⑤过量使用化肥、农药,⑥推广使用无氟冰箱。其中有利于保护环境的是
A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
1.2005年1月,欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星--土卫六。科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其它碳氢化合物。下列关于碳氢化合物的叙述正确的是
A.碳氢化合物的通式为CnH2n+2 B.石油的主要成分是碳氢化合物
C.乙炔是含碳量最高的碳氢化合物 D.碳氢化合物中的化学键都是极性键
29.(15分)
苏丹红一号(sudanⅠ)是一种偶氮染料,不能作为食品添加剂使用。它是由苯胺和
2-萘酚为主要原料制备的,它们的结构简式如下所示:
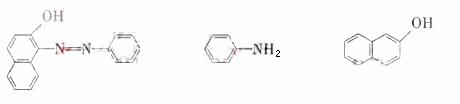
(1)苏丹红-号的化学式(分子式)为
(2)在下面化合物(A)-(D)中,与2-萘酚互为同分异构体的有(填字母代号)
(提示: 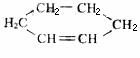 可表示为 )
可表示为 )
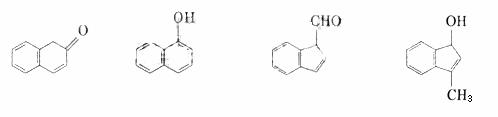 A B
C
D
A B
C
D
(3)上述化合物(C)含有的官能团是
(4)在适当的条件下,2-萘酚经反应可得到芳香化合物E(C8H6O4),1mol E与适量的碳酸氢钠溶液反应可放出二氧化碳44.8L(标准状况),E与溴在有催化剂存在时反应只能生成两种-溴取代物,两种一溴取代物的结构简式分别是 ,E与碳酸氢钠反应的化学方程式是
(5)若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是
反应类型是 。
28.(15分)
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
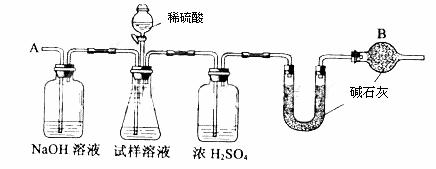
主要步骤如下:
①按图组装仪器,并检查装置的气密性
②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的疏酸接成浓度相同的盐酸,测试的结果 (填偏高、
偏低可不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
27.(15分)
甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
(3)在一定条件下,甲与O2反应的化学方程式是
(4)丁的元素符号是 ,它的原子结构示意图为
(5)丁的氧化物的晶体结构与 的晶体结构相似。
26.(15分)
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
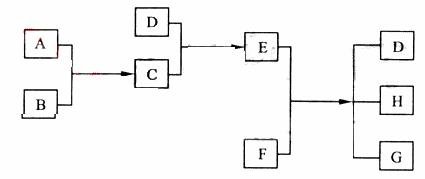
(1)D的化学式(分子式)是 ,E的化学式(分子式)是
(2)A和B反应生成C的化学方程式是
(3)E和F反应生成D、H和G的化学方程式是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com