
27.填空(20分)
(1)试写出纤维素与硝酸反应制取纤维素硝酸醋的化学方程式______
(2)磷酸三丁酵酯是一种常用苯取剂,试写出制备它的化学方程式_______
(3)核糖是一种五碳糖,它的衍生物腺苷也可与磷酸成酯如三磷酸腺苷,后者的分子简式为_____
(4)三磷酸腺苷释放能量的表示式是________
第一步:在A、B试管中分别加入等量的草酸钾和生理盐水(见下图)
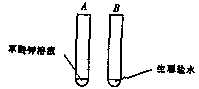
第二步:
……
问题:设置B管的目的是_____
26.(10)分熔融盐燃料电池具有高的发电效率,因而受到重视,可用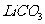 和
和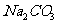 的熔融盐混和物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
的熔融盐混和物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
电池反应式:
阳极反应式:2CO+2CO32 →4CO2+4e
阴极反应式:_____ ______ 总电池反应:______
(1)兔 (2)生理盐水 (3)酒精棉 (4)适宜浓度的草酸钾溶液
(5)透宜浓度的氯化钙溶液 (6)试管、注射器(针管、针头)
27.(14分)
化合物KxFe(C2O4)y·zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3mol/LH2SO4和适量的蒸馏水,加热到75℃,趁热加入0.0500mol/L KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL 0.0500mol/L KMnO4溶液完全反应。通过计算,分别求:
(1)0.491g样品中结晶水的物质的量。
(2)化合物中草酸根的质量分数。
(3)化合物的化学式。
已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
26.(6分)某研究性学习小组欲用化学方法测量一个不规则容器的体积。把35.1gNaCl放入500mL烧杯中,加入150mL蒸馏水。待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释到完全充满容器。从中取出溶液100mL,该溶液恰好与20mL 0.100mol/L AgNO3溶液完全反应。试计算该容器的体积。
25.(10分)
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)
|
烯类化合物 |
相对速率 |
|
(CH3)2C=CHCH3 |
10.4 |
|
CH3CH=CH2 |
2.03 |
|
CH2=CH2 |
1.00 |
|
CH2=CHBr |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系____________________________________________________________________。
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是_____________________(填代号)。
A (CH3)2C=C(CH3)2 B CH3CH=CHCH3
C CH2=CH2 D CH2=CHCl
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH2+HBr CH3CHBrCH3+CH3CH2CH2Br
CH3CHBrCH3+CH3CH2CH2Br
(主要产物) (次要产物)
CH2=CHCH2CH3+H2O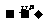 CH3CH(OH)CH2CH3+CH3(CH2)3OH
CH3CH(OH)CH2CH3+CH3(CH2)3OH
(主要产物) (次要产物)
右面框图中B、C、D都是相关反应中的主要产物(部分条件、试剂被省略),且化合物B中仅有4个碳原子、1个溴原子、1种氢原子。
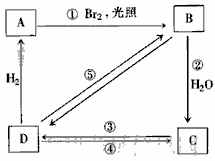
上述框图中,B的结构简式为____________;属于取代反应的有________(填框图中的序号),属于消去反应的有________(填序号);写出反应④的化学方程式(只写主要产物,标明反应条件):________________________________________。
24.(8分)300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为:
(1)用没食子酸制造墨水主要利用了_____________类化合物的性质(填代号)。
A 醇 B 酚 C 油脂 D 羧酸
(2)没食子酸丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为_________。
(3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品添加剂。尼泊金丁酯的分子式为____________,其苯环只与-OH和-COOR两类取代基直接相连的同分异构体有_______种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式__________________。
23.(9分)
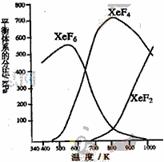
在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到三种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(已知气体的分压之比等于物质的量之比)。
(1)420K时,发生反应的化学方程式为:
________________________________________,
若反应中消耗1mol Xe,则转移电子______mol。
(2)600~800K时,会发生反应:
XeF6(g) XeF4(g)+F2(g),其反应热
XeF4(g)+F2(g),其反应热
△H________0(填“>”、“=”或“<”),理由是___________________________。
(3)900K时,容器中存在的组分有_________________。
22.(12分)钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
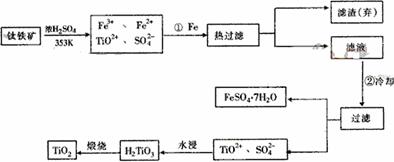
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)步骤①加铁的目的是_______________________________________________;
步骤②冷却的目的是____________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是___________;考虑成本和废物综合利用因素,废液中应加入_________________处理。
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
TiO2 TiCl4
TiCl4 Ti
Ti
已知:①C(s)+O2(g)=CO2(g); △H=-393.5 KJ/mol
②2CO(g)+O2(g)=2CO2(g); △H=-566 KJ/mol
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); △H=+141 KJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=_________________。
反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是____________________。
21.(10分)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬,该过程中将使用到的硅酸盐质实验仪器有_________________(填代号,限填3项)
A 试管 B 瓷坩埚 C 坩埚钳 D 铁三角架
E 泥三角 F 酒精灯 G 烧杯 H 量筒
(2)第2步:I- 溶液的获取。操作是________________________________________。
(3)第3步:氧化操作是依次加入合适的试剂,下列氧化剂最好选用____(填代号)
A 浓硫酸 B 新制氯水 C KMnO4溶液 D H2O2
理由是_______________________________________________________________。
(4)碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com