
6.化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学
 键时释放(或吸收)出的能量。
键时释放(或吸收)出的能量。
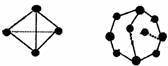
已知白磷和P4O6的分子结构如图所示:
现提供以下化学键的键能(kJ·mol-1)
P-P 198 P-O 360 O-O 498
则反应P4(白磷)+3O2→P4O6的反应热△H为 ( )
A.-1638kJ/mol B.+1638kJ/mol
C.-126kJ/mol D.+126kJ/mol
5.在密闭容器中加少量水,常压下通氨气至饱和,则会建立下列平衡:
 NH3+H2O NH4++OH-。若要使该反应中的OH-浓度增大,应采取的措施是( )
NH3+H2O NH4++OH-。若要使该反应中的OH-浓度增大,应采取的措施是( )
A.水
B.加NH4Cl晶体
C.将氨气的压强增大1倍后,再通入密闭容器中
D.通HCl气体
4.NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.1.0L1.0mol·L-1的FeCl3滴入沸水中,制得的Fe(OH)3胶体粒子数为NA
B.9gD2O中含有的电子数为5NA
C.22.4L的N2和CO的混合气体中所含的原子数为2NA
D.Na2O2与水反应生成1.12LO2(标准状况),反应中转移的电子数为0.1NA
3.下列说法中正确的是 ( )
A.能自发进行的反应都是放热反应 B.凡是熵增加的反应一定能自发进行
C.在一定条件下,吸热反应可自发进行 D.放热的熵增加的反应不一定能够自发进行
2.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、
M分子的元素原子序数均小于10,如下图,则下列判断错误的是 ( )

A.G是最活泼的非金属单质 B.L是极性分子
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
1.2005年9月16日(国际臭氧层日),我省签署了“加速淘汰消耗臭氧层物质行动,创建
国家臭氧层友好省倡议书”,向国际社会庄严承诺;提前1年完成我省淘汰CFCs(全氯
氟烃)两类消耗臭氧层的物质。 ( )
A.无氟冰箱是由于使用不含氟的制冷剂,因而是环保型的。
B.我国目前已投入批量生产的哈龙(灭火剂)替代品一七氟丙烷的化学式是C3HF7
C.汽车尾气、超音速飞机排出的废气及工业废气也可以破坏臭氧层
D.人类广泛脾于制致冷剂、喷雾剂、发泡剂、清洗剂的氟氯烃类化学物质是破坏臭氢层的主要原因。
23.(12分)将总物质的量为4mol的Na2O2和Al2(SO4)3的混合物投入足量水中,充分反应后生成y mol沉淀(y>0)。
(1)试分步写出所有可能发生反应的化学方程式
。
(2)若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值和y=f(x)关系式填写在表内(可不填满,也可补充)。
|
序号 |
x值 |
y=f(x) |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
22.(7分)已知反应CO(g)+H2O(g) CO2(g)+H2(g)的△H>0,在850℃时的平衡常数K=1。850℃时,若向容积为1L的密闭容器中同时充入1.0molCO,3.0molH2O,1.0molCO2,xmolH2,则:
(1)当x=5.0时,试通过计算判断平衡移动的方向。
(2)若要使上述反应开始时向正反应方向进行,求x应满足的条件。
21.(8分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3 :4;M元素原子的最外层电子数与电子层数之比为4 :3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物的水化物的化学式为 。
(2)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1 :1 :1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为
,B的化学式为 。
(3)工业上制取单质M的化学方程式为 。
 五、(本题包括2小题,共19分)
五、(本题包括2小题,共19分)
20.(8分)(1)若AgC1在水中、0.01mol·L-1CaCl2溶液中、0.01mol·L-1NaC1溶液中及0.05mol·L-1AgNO3溶液中的溶解度分别为S1、S2、S3、S4,则S1、S2、S3、S4由大到小的顺序为 。
(2)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
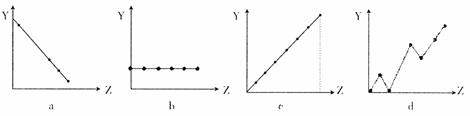
①ⅡA族元素的价电子数 ;
②第3周期元素的最高化合价 ;
③F-、Na+、Mg2+、Al3+的离子半径 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com