
5.X、Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是 ( )
A.X的金属性比Y的金属性强
B.常温下,X和Y都不能从水中置换出氢
C.Y元素的最高价氢氧化物碱性比X元素最高价氢氧化物碱性强
D.Y元素的最高化合价比X元素的最高化合价高
4.下列叙述中,正确的是 ( )
A.含最高价元素的化合物,一定具的强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失电子越多,还原能力越强
D.强氧化剂与强还原剂不一定能发生氧化还原反应
3.向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束,下列结果不可能出现的是( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜均无
2.设NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.2.4g金属镁变成镁离子时失去的电子数目为0.1NA
B.2g氢气所含原子数目为NA
C.在25℃、压强为1.01×105Pa时,11.2L氮气所含的原子数目为NA
D.17g氨气所含电子数目为10NA
1.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学 领域正在经历一场革命性变化。下列说法正确的是 ( )
A.化学不再需要实验 B.未来化学的方向是经验化
C.化学不再是纯实验科学 D.化学仍然是纯实验科学
21.(有机化学基础模块,10分)
已知烃A不能使溴水褪色,A的相对分子质量为106,它在NMR(核磁共振)图谱中有两个信号。A在一定条件下可以发生下列转化:

请回答下列问题:
(1)A结构简式 ;反应②的条件 ;
反应①的反应类型 。
(2)写出反应③的化学方程式: .
(3)F在浓硫酸加热条件下反应得到的产物是一种气体,请写出与该气体属于同类物质的所有可能的同分异构体的结构简式(包括顺反异构): 。
20.(物质结构与性质模块,10分)
有A、B、C、D、E五种元素,其中A、B、C、D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csc cpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D。
(1)上述元素中,第一电离能最小的元素的原子结构示意图为 ;D的电子排布式为 ;
(2)下列分子结构图中的 和
和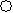 表示上述元素的原子中除去最外层电子的剩余部分,
小黑点表示没有形成共价键的最外层电子,短线表示共价键。
表示上述元素的原子中除去最外层电子的剩余部分,
小黑点表示没有形成共价键的最外层电子,短线表示共价键。
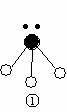
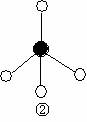
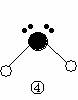
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写分子的化学式); 在③的分子中有 个σ键和 个π键。
(3)A、C、D可形成既具有离子键又具有共价键的化合物,其化学式可能为 ;C的氢化物水溶液与足量AgNO3 溶液反应生成的配合物,其化学式为 ,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:
。
19.(化学与技术模块,10分)
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上使用的“海水淡化”主要技术有 。
(2)工业上利用电解饱和食盐水可制得重要化工产品,用离子交换膜电解槽电解饱和食盐水,反应的离子方程式是 ,阳离子交换膜的作用是
。若不使用离子交换膜法电解食盐水,可得到一种消毒液,其反应的化学方程式是 。
(3)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,写出此过程中SO2 被吸收以及又生成可被回收的气体的两个反应的化学方程式 。
18.(化学与生活模块,10分)
化学与我们的生活息息相关,合理使用化学物质,提高生活质量是应引起我们关注的问题。请回答下列问题:
(1)1989年世界卫生组织把铝列为食品污染物之一,一个成年人每日摄入量应控制在4mg以下,因铝元素含量较多会引发人体患老年性痴呆。铝在下列应用时应加以控制的是
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾与苏打制食品膨松剂 ⑥用氢氧化铝凝胶制胃舒平药片 ⑦制银白色油漆 ⑧铝制易拉罐 ⑨用铝箔包装糖果和小食品。
(2)随着人们生活水平的提高,居室装修成为大众时尚,但居室污染也成为主要的健康杀手之一。室内装修材料释放出的有毒气体主要是 ,建筑石材放射出的有害气体主要是 ,这二者都会对人体健康造成严重威胁,如引发癌症等。
(3)铁是人体必须的微量元素之一,当铁的摄入量不足时,可能会导致缺铁性贫血,对于缺铁人群可以服用补铁剂或补铁保健品。下列可以作为补铁剂的是 (填字母序号)。
A.硫酸亚铁 B.硫酸铁 C.葡萄糖酸亚铁 D.乳酸亚铁
设计实验检验某补铁保健品中是否含有铁,写出实验步骤、现象、结论和相关反应的离子方程式。
17.(10分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。 查得的资料如下:
(1)碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
(2)等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图所示:
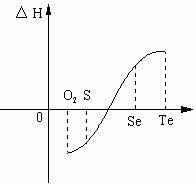
请回答下列问题:
(1)H2与硫化合的反应 热量(填“放出”或“吸收”)。
(2)已知H2Te分解反应的△S>0,请解释为什么Te和H2不能直接化合
。
(3)H2S的水溶液显弱酸性,写出其电离方程式 ;在一定温度下,它的第一级电离常数可用 Ka表示,Ka 值越大,表示_________________,Ka值大小与温度的关系是:温度升高,Ka 值______________(填一定增大、一定减小、或可能增大也可能减小)。
(4)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol SO2、
1 mol O2 和4 mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容
器中SO2转化率分别为α 甲、α 乙,甲容器中平衡常数表达式为 ,此时α 甲 α 乙(填“大于”、“小于”或“等于”)。
第Ⅲ卷 非选择题(选做)
(包括4小题,每小题10分。考生最多可从中选做2小题,若多选作,按照模块呈现的顺序首先作答的计分。满分20分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com