
25.(11分)Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂,常采用下列方法制取:将亚硫酸钠溶液与硫硫粉混合共热,生成硫代硫酸钠(Na2SO3+S=Na2S2O3),滤去硫粉,将滤液浓缩、冷却,即有Na2S2O3·5H2O晶体析出。该法制得的晶体中常混有少量Na2SO3和Na2SO4杂质。
为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量(g) |
12.60 |
18.90 |
28.00 |
|
SO2的体积(L) |
1.12 |
1.68 |
2.24 |
|
硫的质量(g) |
1.28 |
1.92 |
2.56 |
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
通过计算确定样品的成分及各成分的物质的量之比。
24.(12分)在实验室中拟用氧化铜、稀硫酸、和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案。
甲:(1)CuO溶于适量稀硫酸中;
(2)在(1)的溶液中加入适量锌,反应一段时间后,过滤、烘干,即得纯净的铜。
乙:(1)锌与稀硫酸反应得氢气;
(2)利用中学化学中教材H2和CuO的反应装置,将氢气通入氧化铜中并加热,充分反应一段时间后即得纯净的铜。问:
①若要制得相同质量的纯铜,甲乙所耗用的锌和稀硫酸是否相同?为什么?
②丙同学认为在上述两种方案中,即使充分反应一段时间,所制得的铜仍混有杂质难以保证纯度,应对上述两种方案加以完善。你是否赞同丙同学的看法?为什么?你认为应怎样补充完善甲、乙两个实验方案?
23.(12分)某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用图示装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如附表:

|
(1)写出Na2O2和H2O反应的化学方程式 。
(2)计算过氧化钠的质量分数时,必需的数据是 ;
不必作第6次读数的原因是 。
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
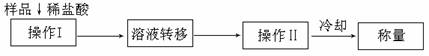
①操作II的名称是 。
②需要直接测定的物理量是 。
③测定过程中需要的仪器有电子秤、蒸发皿、酒精灯,还需要 、
(固定、夹持仪器除外)。
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果
(填偏大、偏小或不变)。
22.(13分)已知A为中学化学中的常见金属,X、Y为常见非金属,A、X、Y都位于周期表中短周期。其中A、Y常温下为固体,X、E、F、G、J常温下为气体,C为无色液体,B是一种盐,受热易分解,分解产物为E和HCl。现用A与石墨作电极,BCY的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图(部分反应的条件、生成物被略去):

请填写下列空白:
(1)金属A为 ;操作a是将D溶液在HCl气流中蒸干,原因是
。
(2)反应②的化学方程式为: ;
反应⑤的化学方程式为: 。
(3)原电池反应①中,正极反应式为: 。
21.(12分)X、Y是短周期元素的单质,W、V是化合物,它们有如下反应:
X+W→Y+V。试写出符合下列要求的化学方程式。
(1)若X、Y是同族单质
①W是H2O:
②W、V是均是氧化物:
(2)若X、Y是不同族的单质
①W、V是均是氢化物:
②W、V是均是氧化物:
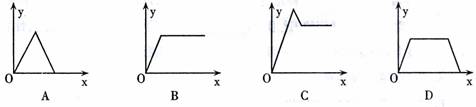
20.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液直至过量,下列表示氢氧化钠加入量(x)与溶液中沉淀物的量(y)的关系示意图中正确的是 ( )
第Ⅱ卷(非选择题,共60分)
相对原子质量:H-1 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5 Cu-64
19.向盛有BaCl2溶液的甲、乙两试管中分别通入SO2至饱和,若向甲试管中加入足量HNO3溶液,乙试管中加入足量NaOH溶液,则下列叙述正确的是 ( )
A.甲、乙两试管均有白色沉淀生成 B.甲、乙两试管均没有白色沉淀生成
C.甲试管没有白色沉淀生成而乙试管有 D.甲试管有白色沉淀生成而乙试管没有
18.铜与1mol·L-1的硝酸反应,如果c(NO3-)下降0.2mol·L-1,则溶液中c(H+)同时下降(假设反应前后溶液体积不变) ( )
A.0.2 mol·L-1 B.0.4 mol·L-1 C.0.6 mol·L-1 D.0.8 mol·L-1
17.浓盐酸和Ca(ClO)2能发生如下反应:Ca(ClO)2+4HCl(浓)====CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉与浓盐酸反应制得的YCCl2中,不可能含有杂质气体是 ( )
A.CO2 B.HCl C.H2O D.ClO2
16.以石墨棒作电极电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极上析出铜的质量是 ( )
A.8g B.16g C.32g D.64g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com