
1.下列叙述正确的是( )
A.强电解质都是离子化合物,因此NaCl是离子化合物
B.醋酸溶液的导电能力可能比稀硫酸强
C.SO3溶于水,其水溶液能导电,SO3是电解质
D.硫是单质,不导电,因此硫是非电解质
33.过氧化钙( CaO2)是一种完全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某 过氧化钙样品的组成,进行了如下实验:
①称取0.270 g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下体积为33.6 mL。
②另取0.120 g样品,溶于稀盐酸,加热煮沸,使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化为CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.02 00 mol/L KMnO4溶液滴定,共用去31.0 mL KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
(1)写出CaO2受热分解的化学方程式。
(2)计算样品中CaO2的质量分数。
(3)计算样品中CaO2·xH2O的x值。
32、有一透明溶液,已知其中可能含有Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、SO42-、HCO3-。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混合气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实验现象及数据判断:
(1)淡黄色粉末的名称为 ;
(2)溶液中肯定有 离子,肯定没有 离子,可能有________离子;
(3)加入淡黄色粉末的物质的量由0.4mol至0.45mol时,沉淀部分消失,反应的离子方程式为 ;
(4)溶液中阳离子的物质的量之比为(H+及没有确定的离子除外) 。
31.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
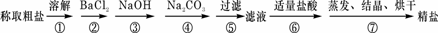
 (1)判断BaCl2已过量的方法是 ;
(1)判断BaCl2已过量的方法是 ;
(2)第④步中,相关的离子方程式是 ;
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
(4)为检验精盐纯度,需配制150 mL0.2 mol/L NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是
30.根据测定硫酸铜晶体中结晶水含量的实验,填写下列空白:
(1)本实验至少需要加热 次,至少需要称量 次;
(2)某学生实验得到以下数据:加热前容器的质量为m1,容器和晶体的总质量为m2,加热后容器和无水CuSO4的总质量为m3。请写出结晶水含量(ω)的计算公式并求出CuSO4·nH2O中n的值(用ml、m2、m3表示):ω= ,n = ;
(3)若ml = 5.4g、m2 = 7.9g、m3 = 6.8g,该生结果 (填“偏高”或“偏低”)?从下列分析中选出该生实验产生误差的原因可能是(填写字母) 。
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量差大于0.1g
C.加热后容器未放在干燥器中冷却 D.加热过程中有少量晶体溅出
E.加热后的粉末中有少量黑色固体
29.如图所示,若电解5min时铜电极质量增加2.16g,试回答:
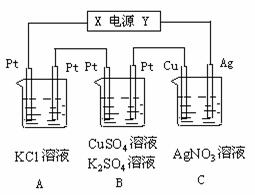
(1)电源电极X名称为 ;
(2)pH变化:A 、B 、C ;
(3)通过5min时,B中共收集224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为 。
(4)写出A中发生的电解方程式 。
28. 1840年盖斯根据一系列实验事实得出规律,他指出:若是一个反应可以分几步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。已知热化学方程式:
C(S,金刚石) + O2(g) = CO2(g);△H = -395.41KJ/mol
C(S,石墨) + O2(g)= CO2(g);△H = -393.51KJ/mol
则金刚石转化为石墨的热化学方程式为 ,由热化学方程式看来更稳定的碳的同素异形体是 。
27.在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变为蓝色,其反应的离子方程式为 。在上述蓝色溶液中滴入足量的Na2SO3溶液,蓝色立即消失,其反应的离子方程式为 ,从以上实验可知, ClO-、I2、SO42-的氧化性由强到弱的顺序 。
26.把 2gCu2S 和CuS 的混合物在酸性溶液中用400mL0.075mol /L KMnO 4溶液处理,发生反应如下:
8MnO 4-+5 Cu2S+44H+=10Cu 2++5SO2+8Mn 2++22H2O;
6MnO 4-+5 CuS+28H+=5 Cu 2++5SO2+6Mn 2++14H2O。反应后煮沸溶液,赶尽SO2,剩余的KMnO 4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO 4-+ Fe2+ + H+= Mn2++ Fe3++ H2O;
(2)KMnO 4溶液与混合物反应后,剩余KMnO 4的物质的量为 mol;
(3)欲配制500mL0.1 mol /L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g;
(4)混合物中Cu2S的质量分数为 。
25、 如图锥形瓶中盛有气体X,滴管内盛有液体Y。若挤压滴管头,使Y滴入瓶中,振荡,过一会儿可见小气球a鼓起。气体X和液体Y不可能是
如图锥形瓶中盛有气体X,滴管内盛有液体Y。若挤压滴管头,使Y滴入瓶中,振荡,过一会儿可见小气球a鼓起。气体X和液体Y不可能是
A、X是NH3、Y是水 B、X是NO2、Y是NaOH溶液
C、X是CO2、Y是稀硫酸 D、X是HCl、Y是NaNO3溶液
二 非选择题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com