
15(8分)请结合所学知识设计实验,证实AlO2−结合H+的能力比CO32−强,供选试剂:NaOH溶液、AlCl3溶液、CuSO4溶液、pH试纸、NaHCO3溶液、FeCl3溶液(仪器自选)。
①能证明AlO2−结合H+的能力强于CO32−的反应的离子方程式:
_____________________________________________________。
②实验操作要点如下:
a:取少量的 溶液于试管中;
b:向试管中逐滴加入NaOH溶液直至 ;
c:向其中再滴入 溶液至足量。
16(10分)亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到。亚硝酰氯(ClNO)有关性质如下:
|
分子式 |
ClNO |
别名 |
氯化亚硝酰 |
溶解性 |
溶于浓硫酸 |
|
熔点 |
-64.5℃ |
沸点 |
-5.5℃ |
性状 |
红褐色液体或有毒气体, 具有刺激恶臭,遇潮湿空气分解成氮的氧化物与氯化氢 |
某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。如图所示。实验开始前K1、K3均已关闭,但K2却打开着。、
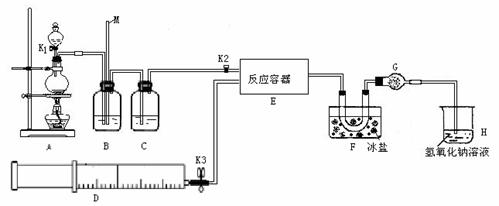
试回答下列问题:
(1)如何检查A、B、C所组成的实验装置气密性? 。
(2)若D中装有纯净的NO气体,则B中应选用最佳试剂为 ,B的作用为:① ;② 。
(3)F中U型管的作用: ;干燥管G作用: 。
(4)某同学认为氢氧化钠溶液只能吸收氯气和ClNO,但不能吸收NO。所以装置H不能有效除去有毒气体,写出你改进措施:________________________________。
14.将4.9g Mg和Fe的混合物在一定量的稀HNO3溶液中完全溶解(溶液中有Fe2+),得到标况下气体2.24L(假设全为NO气体),则向反应后的溶液中加入足量的烧碱,在空气中不断搅拌,充分反应后,则生成沉淀的质量是 ( )
A. 6g B. 8g C. 10g D. 12g
第Ⅱ卷(共58分)
13.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。已知单质硅、SiO2均为空间四面体结构,Si-O、 O=O、Si-Si键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,则反应Si(s) + O2(g) 高温 SiO2(s)的△H约为
A.(c+b-2a) kJ·mol-1 B.(c+b-4a) kJ·mol-1
C.(2c+b-2a) kJ·mol-1 D.(2c+b-4a) kJ·mol-1
12.下列离子方程式书写正确的是( )
 A.NaHSO3溶液显弱酸性是因为:HSO3- +H2O
A.NaHSO3溶液显弱酸性是因为:HSO3- +H2O 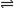 SO32-
+H3O+
SO32-
+H3O+
B.尼泊金酸( )与碳酸氢钠溶液反应:


+2HCO3- → + 2CO2↑+ 2H2O
C.电解氯化镁溶液时电极反应的离子方程式是:2Cl-+2H2O=Cl2↑+H2↑+2OH-
D.1 L 2 mol/L的FeBr2溶液中通入2.5 mol Cl2:2Fe2++8Br- + 5Cl2 =10Cl-+2Fe3++4Br2
11.室温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol·L-1的氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=b mol 。a、b正确的答案组合是
A.9-11之间;0.1 B.9-11之间;0.2
C.12-13之间;0.2 D.13;0.1
10.下列操作或实验数据记录正确的是( )
A.用2 mol/L FeCl3溶液和4 mol/L NaOH溶液混合制Fe(OH)3胶体
B.用标准NaOH溶液滴定未知浓度的盐酸用去NaOH溶液2.3mL
C.用pH试纸测溶液的pH时,应先将试纸湿润再滴待测溶液
D.在试管中制备Fe(OH)2时,将吸有NaOH溶液的滴管插入FeSO4溶液液面下
9.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
下列叙述正确的是( )
A.电解质溶液可为酸性介质
B.放电时负极反应为:Fe(OH)3 +5OH-+3e
 FeO
FeO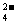 +4H2O
+4H2O
C.充电时每转移3mol电子,有1mol Fe(OH)3被氧化
D.放电时Zn为正极
8.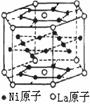 氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如下图所示。则这种合金的化学式为 ( )
氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如下图所示。则这种合金的化学式为 ( )
A.LaNi6 B.LaNi3 C.LaNi4 D.LaNi5
7、下列操作中一定无强酸生成的是
A、将CO2通入CaCl2溶液中
B、将SO2通入Ba(NO3)2溶液中
C、将H2S通入CuSO4溶液中
D、将CO2通入Ca(ClO)2溶液中
6.铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O72-离子还原为Cr3+离子,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物(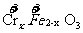 ·
·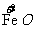 )。处理含1 mol Cr2O72-的废水至少需要加入a mol FeSO4·7H2O,下列结论正确的是( )
)。处理含1 mol Cr2O72-的废水至少需要加入a mol FeSO4·7H2O,下列结论正确的是( )
A.x=1,a=5 B.x=0.5 a=8 C.x=1,a=10 D.x=0.5,a=10
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com