
12、下列离子方程式书写正确的是( )
 A.NaHSO3溶液显弱酸性是因为:HSO3- +H2O
A.NaHSO3溶液显弱酸性是因为:HSO3- +H2O 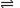 SO32-
+H3O+
SO32-
+H3O+
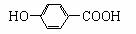
B.尼泊金酸( )与碳酸氢钠溶液反应:

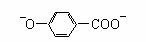
+2HCO3- → + 2CO2↑+ 2H2O
C.电解氯化镁溶液时电极反应的离子方程式是:2Cl-+2H2O=Cl2↑+H2↑+2OH-
D.1 L 2 mol/L的FeBr2溶液中通入2.5 mol Cl2:2Fe2++8Br- + 5Cl2 =10Cl-+2Fe3++4Br2
11、已知Cu+2Fe3+==Cu2++2Fe2+ Zn+2Fe3+==2Fe2++Zn2+ 现把等物质的量的CuSO4、FeCl3和Zn于水中充分反应,所得混合物中除SO42-、Cl-外,还含有( )
(A)Zn2+、Fe3+、Cu (B)Cu2+、Fe3+、Zn
(C)Zn2+、Fe2+、Cu2+、Cu (D)Zn2+、Cu2+、Fe2+、Fe
10、已知热化学反应方程式:Zn(s)+ O2(g)
O2(g) ZnO(s);ΔH=-351.5 kJ·mol-1; Hg(l)+
ZnO(s);ΔH=-351.5 kJ·mol-1; Hg(l)+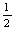 O2(g)
O2(g)
 HgO(s);ΔH=-90.84 kJ·mol-1,则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)
HgO(s);ΔH=-90.84 kJ·mol-1,则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)  ZnO(s)+Hg(l)的ΔH为( )
ZnO(s)+Hg(l)的ΔH为( )
A.、ΔH=+260.7 kJ·mol-1 B、.ΔH=-260.7 kJ·mol-1
C、.ΔH=-444.2 kJ·mol-1 D.、ΔH=+444.2 kJ·mol-1
9、根据下表下列叙述中正确的是:
|
序号 |
氧化剂 |
还原剂 |
其它反应物 |
氧化产物 |
还原产物 |
|
① |
Cl2 |
FeBr2 |
|
|
FeCl3 |
|
② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
MnSO4 |
|
③ |
KClO3 |
HCl(浓) |
|
Cl2 |
Cl2 |
|
④ |
KMnO4 |
HCl(浓) |
|
Cl2 |
MnCl2 |
A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B.氧化性比较: KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较: H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数为16
8、设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下22.4L PCl3中含有的原子数为4NA
B.标准状况下22.4L NO2中含有的原子数为3NA
C.1mol FeCl3若完全水解可以形成NA个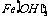 胶粒
胶粒
D.2.90g 熟石膏(2CaSO4·H2O)晶体中结晶水的数目0.01NA个
7、下列各组离子,在指定的条件下能大量共存的是( )
A、水电离出来的c (OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
B、在c(H+)=10-14mol/L的溶液中可能含:Na+,A102-,CO32-,SO32-
C.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
D. 某溶液,加铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
6、下列有关叙述正确的是( )
A. 亚硝酸盐作为工业用盐,在食品中作防腐剂和增色剂,用量无严格限制
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
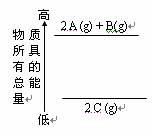
C. 右图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为: 2 A(g)+ B(g) = 2 C(g);△H=Q kJ·mol-1(Q<0 )
D.电解水制取氢气和氧气时,通常加入硫酸钠等强电解质,这说明强电解质的导电性比弱电解质的导电性强
21.某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-。现每次取100.00mL进行实验。
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩2.33g。
试回答下列问题:
(1)c(CO32-)=
(2)K+是否存在? ;若存在,浓度 mol/L(若不存在,则不必回答第二问)。
(3)根据以上实验,有没有哪种离子不能判断是否存在?若有,这种离子应如何进行检验?
19(5分)近期大面积持续“油荒”、“电荒”,严重影响了生产、生活,能源成了亟待解决的问题。解决能源危机,除了政策调控外,新能源的开发利用才是根本的有效途径。
⑴直馏汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在C5-C11范围内,如戊烷,它有三种同分异构体,其沸点由高到低的顺序为 (用结构简式表示)。
⑵科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量。
即:H2(g)十1/2 O2(g)→H2O(l);△H=-285.5kJ/mol
但目前世界上的氢绝大部分是从石油、煤炭和天然气中制取。请写出工业上由天然气和水蒸气反应制氢气的化学反应方程式。________________________________________。
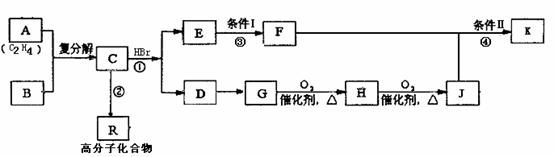
20(10分)某学生根据法国科学家YvesChauvin、美国科学家RobertH.Grubbs、RichardR.Schrock在烯烃复分解反应方面共同研究与应用的成果,结合所学的知识合成某些有机物K和R。其中K的结构简式为:C6H5CH2COOCH(CH3)C6H5
其合成路线设计如下 :
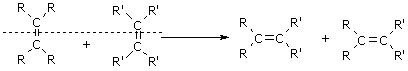
 已知:烯烃的交叉复分解反应机理为双键断裂、换位连接。可表示为:
已知:烯烃的交叉复分解反应机理为双键断裂、换位连接。可表示为:
试回答下列问题:
(1)写出B的结构简式: ,D的结构简式:
(2)①②③④中属于取代反应的有 (填序号);反应条件Ⅰ为: 。
(3)并写出④的反应化学方程式: 。
(4)写出分子式与J相同,不属于酯类化合物,结构上含有一个苯环且苯环上只有一个侧链的同分异构体的结构简式: (任写2种即可)。
17(7分)A、B、C、D为周期表中前三周期元素,A元素原子的次外层电子数是最外层电子数的1/2,B的阴离子核外只有一个电子层,C单质在标准状况下密度是1.43g·L-1,D元素的焰色反应呈黄色。将以上四种元素组成的结晶盐M 3.4 g加热反应至完全失去结晶水,其质量减少1.35 g,所得无水盐中C元素的质量分数为39%,将该无水盐与适量盐酸作用得到一种弱酸,再将所得弱酸完全燃烧可得0.9g水和1.12L标准状况下的CO2,已知这种弱酸的-个分子中共有32个质子。试回答:
(1)A、B、C、D四种元素各是什么元素:A、 B、 C、 D 。(填元素符号)
(2)结晶盐M的化学式为 。
18(10分)右边框图中的物质是中学化学中常见的物质,已知B、E在常温下为气态,其余均为固体,其中D是一种淡黄色固体。试根据框图和所学知识回答下列问题:
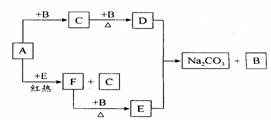
(1)写出D的化学式和E的电子式:D的化学式 、E的电子式 。
(2)A+E→C+F的反应方程式为 。
(3)往饱和Na2CO3溶液中不断通入E气体,会看到溶液变浑浊(有白色固体析出),写出该反应的化学方程式 。
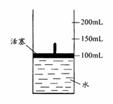 (4)将A、D按一定比例投入下图容器的水中,活塞由100mL处上升到200mL处。现用电火花引燃容器内的气体,在条件不变的情况下,若活塞由200mL处回到150mL处,则原则来投入的A、D物质的物质的量之比为n(A)∶n(D)= 。(假设上述操作能顺利实现,且忽略因投入A、D以及气体溶于水使水面高度变化的影响。)
(4)将A、D按一定比例投入下图容器的水中,活塞由100mL处上升到200mL处。现用电火花引燃容器内的气体,在条件不变的情况下,若活塞由200mL处回到150mL处,则原则来投入的A、D物质的物质的量之比为n(A)∶n(D)= 。(假设上述操作能顺利实现,且忽略因投入A、D以及气体溶于水使水面高度变化的影响。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com