
23.(9分)
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
请回答下列问题:
(1)B与D两元素相比较,非金属性较强的是_____________(填元素名称),可以验证该结论的实验是________________(填写编号);
A.比较这两种元寡的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氧化物的难易
(2)写出两种均含A、B、C、D四种元素的化合物相互问发生反应,且生成气体的离子方程式______________________________________________:
(3)A、B、D问可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为_________________________________;
(4)D元素的气态氯化物和其低价氧化物能反应生成D的单质.该反应中氧化产物与还原产物的物质的量之比为_________________。
22.(8分)
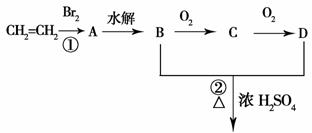 由乙烯和其他无机原料合成环状
化合物其合成过程如下(水及其他无机产物均已省略):
由乙烯和其他无机原料合成环状
化合物其合成过程如下(水及其他无机产物均已省略):
请分析后回答下列问题:
(1)反应的类型分别是①_____________、②________________;
(2)D物质中的官能团为___________________________;
(3)C物质的结构简式___________________,物质X与A互为同分异物体,则X的结构简式为______________________,X的名称为_______________________________;
(4)A→B的化学方程式(注明反应条件)______________________________________。
21.(7分)
下图为中学化学中几种常见物质的转化关系(部分产物已略去):
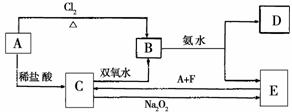
将lmol·L-1的B溶液滴入沸水中可得到以E为分散质的红褐色胶体。
请回答下列问题:
(1)写出化学式A___________,F____________,双氧水(H2O2)的电子式____________;
(2)鉴定D中阳离子的实验方法和现象________________________________________;
(3)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为E,该反应的离子方程式为:_______________________________________________________________________。
20.(9分)
某兴趣小组同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。 请回答下列问题:
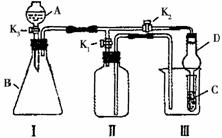
(1)利用装置I制取气体,生成气体的反应应具备的条件是__________________;
(2)利用Ⅰ、Ⅱ装置制取气体(K2关闭,K1打开)。
甲同学认为:利用Ⅱ装置可以收集H2、NH3等气体,但不能收集O2和NO2等气体.其理由是: _______________________;
乙同学认为:利用Ⅱ装置作简易改进(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是_______________________,利用Ⅱ装置再作简易改进(不改变仪器装置),也可收集NO2气体,改进的方法是__________________________;
(3)利用I、Ⅲ装置验证物质的性质(K2打开,K1关闭)。
如设计实验证明氧化性:KMnO4>Cl2>Br2.则在A中加浓盐酸,B中加___________,
C中加______________,观察到C中的现象是_____________________________。
19.(4分)
下列有关实验或做法中,正确的是(填序号,错选倒扣分)_________________。
A.配制480mL、1.0mol·L-1NaOH溶液时,需称取NaOH固体的质量为20.0g
B.用分液的方法分离苯和水的混合物
C.在同温同压下,等质量的硫在足量的氧气中比在足量的空气中燃烧放出的热量多
D.将mgCO和H2的混合气体完全燃烧后通过过量的Na2O2固体(气体充分反应),固体增重mg
E.排空气法收集一瓶干燥的氨气做喷泉实验,最后液体充满整个容器
F.在实验室制乙烯时.温度计的水银球一定要浸入液面以下并加入碎瓷片防暴沸
G.试纸在使用前需用蒸馏水湿润,然后进行相应试验
2.答卷前将密封线内的项目填写清楚。
18.将5.6g Cu、Mg合金投入到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下混合气体VL(HNO3被还原为NO和NO2);若向反应后的溶液中加入足量氢氧化钠溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称量质量为10.7g,则收集到的气体体积V值可为
A.2.24L B.4.48L C.6.72L D.7.84L
第Ⅱ卷(非选择题共54分)
注意意项:
l.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试卷中(除题目有特殊规定外)。
17.A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。则下列叙述正确的是
A.x、Y、Z三种化合物的稳定性逐渐减弱
B.A、B、C、D四种元素只能形成五种单质
C.X、Y、Z三种化合物的熔沸点逐渐升高
D.四种元素形成的单质中不存在原子晶体
16.t℃时,甲、乙两个烧杯中各盛有100g(密度为1.10g·cm-3)相同浓度的KCl溶液。现将甲烧杯中的溶液蒸发掉35.0g水,恢复到t℃时析出KCl固体5.0g;乙烧杯中的溶液蒸发掉45.0g水,恢复到t℃时析出固体10g。则下列说法正确的是
A.原溶液中溶质质量分数为20%
B.t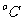 时KCl的溶解度为50.0g
时KCl的溶解度为50.0g
C.原溶液的物质的量浓度为3.0mol·L-1
D.乙烧杯中剩余KCl溶液的物质的量浓度大于甲烧杯中剩余KCl溶液物质的量浓度
15.已知合成氨的反应为:N2(g)+3H2(g)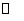 2NH3(g);△H=-QkJ·mol-1(Q>0)。在同温同压下向密闭容器甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;向另一容积相同的密闭容器乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是
2NH3(g);△H=-QkJ·mol-1(Q>0)。在同温同压下向密闭容器甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;向另一容积相同的密闭容器乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是
A.2Q2<Ql<Q B.2Q2=Q1<Q C.2Q2=Q1=Q D.Ql<Q2<Q
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com