
8.关于0.1mol/L碳酸钠溶液的叙述正确的是
A.溶液中粒子的种类共有6种
B.加水稀释时溶液中所有离子浓度均减小
C.升高温度,平衡向促进水解的方向移动
D.加入氢氧化钠的固体,可以使溶液中c(Na )∶c(CO
)∶c(CO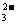 )=2∶1
)=2∶1
7.右图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是
|
|
|
||
|
X |
|
|
|
|
Y |
Z |
|
|
|
|
|
W |
|
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①②
C.①②③ D.①②③④
6.在Zn+HNO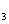 --Zn(NO
--Zn(NO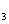 )
) +NH
+NH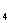 NO
NO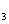 +H
+H O的反应中,如果2mol Zn完全反应,则被还原的HNO
O的反应中,如果2mol Zn完全反应,则被还原的HNO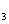 的物质的量是
的物质的量是
A.0.5mol B.1mol C.2mol D.5mol
5.下列叙述正确的是
A.不能跟酸反应的氧化物一定能跟碱反应
B.同一主族的元素的气态氢化物相对应分子质量越大,它的沸点一定越高
C.在CCl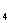 、PCl
、PCl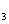 、HCl中各原子最外层均能达到8电子的稳定结构
、HCl中各原子最外层均能达到8电子的稳定结构
D.升高温度可加快反应速率,其主要原因是反应物分子能量增加,活化分子百分数增加,使有效碰撞次数增多
4.用铂电极电解下列物质的溶液,当耗电量相同时,阴极和阳极上同时都有气体产生,且溶液的pH下降的是
A.H SO
SO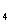 B.CuSO
B.CuSO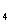 C.HCl D.KCl
C.HCl D.KCl
3.下列热化学方程式中,能够表示物体燃烧热的是
A.C(s)+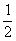 O
O (g)=CO(g);
(g)=CO(g);
 H=-110.5kJ/mol
H=-110.5kJ/mol
B.H (g)+Cl
(g)+Cl (g) =2HCl(g);
(g) =2HCl(g);
 H=-184.6kJ/mol
H=-184.6kJ/mol
C.H (g)+
(g)+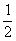 O
O (g)= H
(g)= H O(g);
O(g);
 H=-241.8kJ/mol
H=-241.8kJ/mol
D.C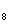 H
H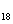 (g)
(g)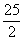 O
O (g)=8CO
(g)=8CO (g)+9H
(g)+9H O(l);
O(l);  H=-5518kJ/mol
H=-5518kJ/mol
2.下列叙述正确的是
A.原子晶体中只存在非极性共价键
B.干冰升华时,分子内共价键会发生断裂
C.由原子构成的晶体可以是原子晶体,也可以是分子晶体
D.只要含有金属阳离子的晶体就一定是离子晶体
1.下列说法正确的是
A.饮用水就是纯水,是纯净物
B.有机食品,就是有机合成的食品
C.将化工厂的烟囱建高,不能缓解大气污染
D.燃煤时,鼓入过量的空气可以减少酸雨的产生
25.(6分)
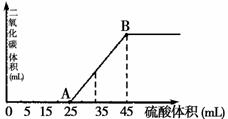
将5.0g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1lmol·L-1的硫酸,所加入硫酸的体积与产生CO2的体积(标准状况)关系如图所示:
(1)写出从开始加入硫酸到A点所发生反应的离子方程式________________________;
(2)当加入35mL硫酸时,产生二氧化碳的物质的量为_____________________mol;
(3)计算原混合物中氢氧化钠的质量分数。
24.(11分)
有如下化学反应:2A(g)+B(g)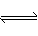
 2C(g),△H<0。
2C(g),△H<0。
(1)若将4molA和2molB在2L的容器中混合,经2s后测得C的浓度为0.6tool·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_______________;
(2)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:n(A)+n(B)=n(C),则A的转化率为_________________;
(3)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分散再达到与原平衡状态相同,可采取的措施有________________________
_________________________________________________。
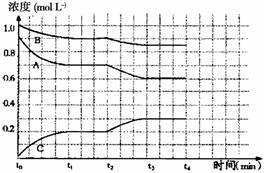
(4)右图是一定条件下该反应过程中,体系内各物质浓度的变化情况。反应处于平衡状态的时间是____________,t2时曲线发生变化的原因是__________________,若在t4时将B的浓度增大0.lmol·L-1,请在右图中画出各物质浓度的变化情况。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com