
5.美国夏威夷联合天文中心的科学家发现了新的氢微粒,该微粒是由3个氢原子核(只含质子)和2个电子构成,关于这种微粒的下列说法中正确的是( )
(A)是氢元素的一种新的同素异形体 (B)是氢元素的一种新的同位素
(C)该微粒的组成可用H3表示 (D)该微粒比普通氢分子多一个氢原子核
4.下列各离子化合物中,阳离子与阴离子的半径之比最小的是( )
(A)KCl (B)NaBr (C)LiI (D)KF
3.某主族元素的最高价含氧酸的阴离子的符号是RO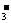 ,则该元素的气态氢化物的化学式是( )
,则该元素的气态氢化物的化学式是( )
(A)HR (B)H2R (C)RH3 (D)RH4
2.自来水用适量氯气杀菌消毒。不法商贩用自来水冒充纯净水谋取暴利,可用化学试剂辩别真伪,该试剂可以是( )
(A)酚酞试液 (B)氯化钡溶液 (C)氢氧化钠溶液 (D)硝酸银溶液
1.发射宇宙飞船的运载火箭的推进剂引燃后,产生大量高温气体从尾部喷出,该气体主要成分是CO2、H2O、N2、NO等,在发射现场可看到火箭尾部产生大量红色气体,其原因是( )
(A)高温下N2遇空气生成NO2 (B)NO遇空气生成NO2
(C)CO2与NO反应生成CO和NO2 (D)NO与H2O反应生成H2和NO2
23.(6分)
在一个温度恒定的密闭容器中,SO 和O
和O 发生反应。已知1mol SO
发生反应。已知1mol SO 和足量O
和足量O 完全反应,放出的热量为Q。请按要求回答下列问题。
完全反应,放出的热量为Q。请按要求回答下列问题。
[恒压条件下]
(1)若开始时放入1mol SO 和0.5mol O
和0.5mol O ,达平衡后,生成0.9mol SO
,达平衡后,生成0.9mol SO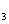 ,这时SO
,这时SO 的转化率为___________;
的转化率为___________;
(2)若开始时放入4 mol SO 和2mol O
和2mol O ,达平衡后,生成SO
,达平衡后,生成SO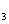 的物质的量为______,反应放出的热量为__________。
的物质的量为______,反应放出的热量为__________。
[恒压条件下]
(3)若开始时放入1 mol SO 和0.5mol O
和0.5mol O ,达平衡后,生成a mol SO
,达平衡后,生成a mol SO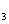 ,则a_______0.9(填“>”、“<”或“=”);
,则a_______0.9(填“>”、“<”或“=”);
(4)若令x、y和z分别代表初始加入SO 、O
、O 和SO
和SO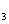 的物质的量,要使达平衡时,反应混合物中三种气体的物质量分数与(3)中平衡时完全相同,则x、y、z必须满足的一般条件是_________________、_________________。(用两个代数式表示,其中一个只含x、y,另一个含x、z)
的物质的量,要使达平衡时,反应混合物中三种气体的物质量分数与(3)中平衡时完全相同,则x、y、z必须满足的一般条件是_________________、_________________。(用两个代数式表示,其中一个只含x、y,另一个含x、z)
22.(8分)
分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式____________________________________;
(2)如右图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是_______________________________;反应需要测量温度,每次测量温度后都必须采取的操作是_________________________________;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm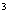 ,又知中和后生成溶液的比热容c=4.18J/(g,℃)。为了计算中和热,实验时还需测量的数据有(填序号)____________________;
,又知中和后生成溶液的比热容c=4.18J/(g,℃)。为了计算中和热,实验时还需测量的数据有(填序号)____________________;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
|
实验序号 |
起始温度t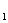 I℃ I℃ |
终止温度t I℃ I℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热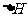 =____________________;
=____________________;
(5)假定该学生的操作完全同上,实验中改用100mL 0.5mol/L盐酸跟100mL 0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
21.(5分)
某校同学为探究Br 、I
、I 和Fe
和Fe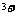 的氧化性强弱,进行了如下实验。
的氧化性强弱,进行了如下实验。
实验①取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl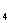 , 振荡后静置,观察到下层液体呈紫红色;
, 振荡后静置,观察到下层液体呈紫红色;
②取少量FeSO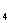 溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
(1)写出实验②中发生氧化还原反应的离子方程式__________________________;
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是(填序号)_________;
A.Br >I
>I B.Fe
B.Fe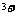 >Br
>Br C.Br
C.Br >Fe
>Fe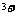 D.I
D.I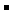 >Br
>Br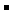
(3)已知Fe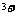 的氧化性强于I
的氧化性强于I ,请你从所给试剂中选择所需试剂,设计一个实验加以证明。
,请你从所给试剂中选择所需试剂,设计一个实验加以证明。
①FeCl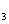 溶液 ②碘水 ③KI溶液 ④稀H
溶液 ②碘水 ③KI溶液 ④稀H SO
SO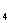 ⑤淀粉液
⑤淀粉液
(友情提示:请写出实验步骤、现象及结论)_________________________________
____________________________________________________________________________。
20.(7分)
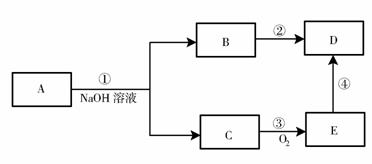 有机物A的分子式为C
有机物A的分子式为C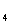 H
H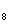 O
O 。转化关系如下图所示。
。转化关系如下图所示。
请回答下列问题:
(1)D物质具有官能团的名称为___________;①的反应类型为_______________;
(2)反应③的化学方程式为___________________________________________;
(3)写出与A同类的A的所有同分异构体的结构简体
____________________________________________________________________。
19.(10分)
A、B、C、D、E均为短周期元素,且原子序数依次递增。A、E同主族,B、D同周期,且B和D最外层电子数之和为10;A与D可形成,A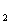 D、A
D、A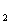 D
D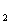 共价化合物。请回答下列问题。
共价化合物。请回答下列问题。
(1)D位于周期表第_______周期,_________族;
(2)E离子的结构示意图为_________________;与E同周期的元素中,金属性最弱的金属元素名称是_________,最稳定的气态氢化物的化学式为_________;
(3)C 的电子式为__________,B与D通常能形成_________晶体,在E
的电子式为__________,B与D通常能形成_________晶体,在E D
D 中含有的化学键有___________________________________;
中含有的化学键有___________________________________;
(4)由A、B、C、D四种元素组成的离子化合物的化学式为(写出一种即可)_______________,组成的共价化合物的结构简式为(写出一种即可)___________________;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com