
1.保护环境是每一个公民的责任和义务。下列做法中,有利于保护环境的是 ( )
①推广使用无磷洗涤剂 ②城市生活垃圾分类处理 ③新农村建设中倡导建造沼气池
④推广使用一次性木质筷子,⑤集中掩埋废旧电池
A.①②③ B.②③④ C.①②⑤ D.①④⑤
20.(14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
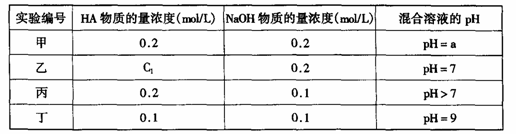
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“是”或“否”)。
混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)= mol/L
c(OH-)-c(HA)= mol/L
19.(12分)在一固定容积的密闭容器中,进行如下化学反应:
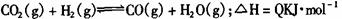
其化学平衡常数K和温度t的关系如下:

请回答:
(1)上述反应中Q 0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
(a) 容器中压强不变 (b) 反应热△H不变
(c) 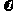 正(H2)=
正(H2)=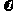 逆(CO)
(d) CO2的质量分数不变
逆(CO)
(d) CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
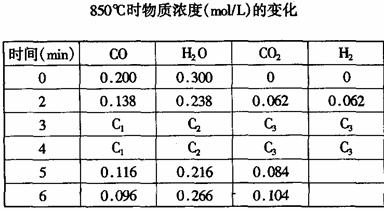
①计算:3min时(CO的浓度)c1=_ _mol/L,H2O(g)的转化率= 。
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min-6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
18.(10分)短周期的四种元素A、B、C、D,原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两元素原子最外电子层上电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A和c可以形成化合物CA3;B与D的原子序数之比为3︰4。请回答:
(1)写出化合物CA3的电子式: 。
(2)由四种元素中的三种组成的甲、乙两种化合物,甲属于盐类,其溶液呈酸性,请用离子方程式表示其溶液呈酸性的原因 。
乙为常见的天然高分子化合物,写出该高分子化合物充分水解的化学方程式:
(3)丙、丁两种化合物,它们均含上述四种元素,既可以与盐酸反应又可以与NaOH溶液反
应,丙为无机盐,其化学式为 ,丁为有机物,且是同类有机物中相对分子质量最小的,其结构式为 。
(4)A和B组成的化合物M,分子中A与B的原子个数比是3︰1,常温常压下,0.5 mol M完全燃烧放出780 kJ的热量,请写出表示M燃烧热的热化学方程式:
17.(8分)下图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物,它们存在如下转化关系(反应中生成的水及次要产物均已略去):
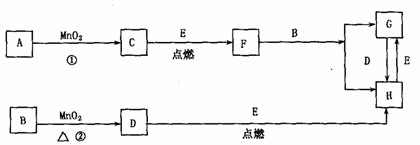
(1)写出化学式:E C
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)若反应①是在加热条件下进行,则A是 ,若反应①是在常温条件下进行,则A是 ,若在上述条件下得到等量的C单质,反应中转移的电子数之比是 (按本题的叙述顺序)。
16.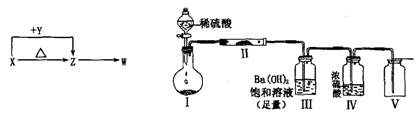 (8分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
(8分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)X与Y在溶液中反应的离子方程式是 。
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用上图装置(夹持固定装置己略去)进行实验,装置Ⅲ中生成白色沉淀,装置V中可收集到一种无色气体。
装置I中反应的化学方程式是 。
装置Ⅱ中反应的化学方程式是 。
装置Ⅲ中反应的化学方程式是 。
15.(6分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将PH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
(2)下列实验没有错误的是
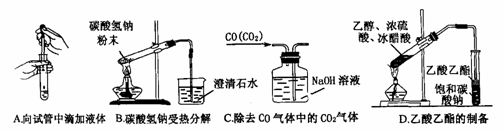
(3)下图为常见仪器的部分结构(有的仪器被放大)
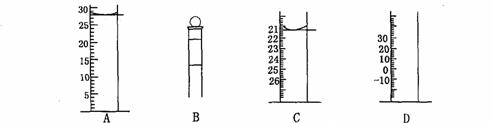
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
14.已知25℃时,电离常数Ka(HF)=3.6×10-4mol/L,溶度积常数Ksp(CaF2)=1.46×10-10mol3/L3。现向1L 0.2mol/LHF溶液中加入1L 0.2mol/LCaCl2溶液,则下列说法中,正确的是
A.25℃时,0.1 mol/LHF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中,Ksp(CaF2)=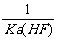
D.该体系中有CaF2沉淀产生
第Ⅱ卷 (非选择题共58分)
13.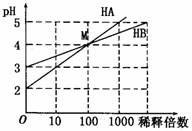 常温时,将HA和HB两种一元酸的溶液分别加水稀释,pH变化如右图所示。下列叙述中正确的是
常温时,将HA和HB两种一元酸的溶液分别加水稀释,pH变化如右图所示。下列叙述中正确的是
A.HA是一种弱酸
B.在M点,c(B-)=c(A-)
C.稀释前,c(HA)=10c(HB)
D.在M点,HA、HB溶液的导电性和电离程度都相同
12.完全溶解28.4g碳酸铜和氢氧化铜的混合物需要消耗1 mol/L的盐酸500mL。若充分灼烧相同质量的上述混合物,能得到氧化铜的质量是
A.20g B.25g C. 30g D.40g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com