
3.下列不符合当今化学研究方向的是 ( )
A.发现新物质 B.合成新材料
C.研究化学反应的微观过程 D.研究化学反应中原子守恒关系
2.以下化学用语正确的是 ( )
A.乙烯的结构简式CH2CH2 B.乙酸的分子式C2H4O2
C.明矾的化学式KALSO412H2O D.氯化钠的电子式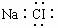
1.很多化学物质名称中含有“水”,“水”通常有三种含义:①表示水这种物质;②表示水溶液;③表示物质处于液态。下列物质名称中的"水"不属于以上三种含义的是 ( )
A.水晶 B.水银 C.溴水 D.重水
26.在一次学生实验中,学生用带有氧化膜的铝片和稀硫酸反应,发现铝片和稀盐酸、稀硫酸反应发现铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应。这和“铝能跟稀盐酸或稀硫酸反应生成氢气”不一致,是什么原因呢?是试剂、药品出了问题吗?为了寻找原因,某学生在教师的指导重新用浓盐酸配制了一定浓度的溶液,然后加入0.1×10×10mm3,纯度≥99.5%的铝片验证是否确实存在上述现象,实验结果如下表
 反应进程 反应进程(分钟) 酸 |
1 |
2 |
5 |
15 |
20 |
|
3mol•L-1HCl |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol•L-1H2SO4 |
均无明显现象(无气泡) |
||||
|
3mol•L-1H2SO4 |
均无明显现象(无气泡) |
无论是用1.5mol•L-1H2SO4还是用3mol•L-1H2SO4,均无明显现象。其结论还是与“铝能跟稀硫酸或稀盐酸反应生成氢气”不相符合。
问题1:为了探索“铝与稀盐酸和稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设或猜想:
假设一:
假设二:
……
问题二:为了论证上述假设,你设计的实验方案是:(探究过程)
结论:
25.(10分)(1)右表为为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
|
烯类化合物 |
相对速率 |
|
(CH3)2C=CHCH3 |
10.4 |
|
CH3CH=CH2 |
2.03 |
|
CH2=CH2 |
1.00 |
|
CH2=CHBr |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率快的是_____________(填代号)。
A、(CH3)2C=C(CH3) 2 B、CH3CH=CH CH3
C、CH2=CH2 D、CH2=CHCl
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3 + HBr → CH3CHBrCH3 + CH3CH2CH2Br
(主要产物) (次要产物)
|
CH2=CH CH2CH3 + H2O → CH3CH(OH)CH2CH3 + CH3CH2CH2 CH2 OH
(主要产物) (次要产物)
下列框图中B、C、D都是相关反应中的主要产物(部分条件、试剂被省略),且化合物B中仅有4个碳原子、1个溴原子、1种氢原子。
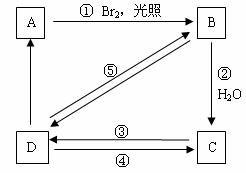
上述框图中,A的结构简式为__________________;属于取代反应的有_______(填框图中序号),写出反应④的化学方程式(只写主要产物,标明反应条件):______ _________________。
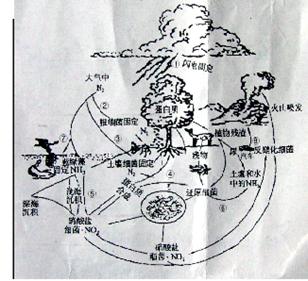
24.右图是自然界中氮的循环图。请根据图回答下列问题:
(1)循环过程中属于氮的固定的是
(2)日本东京和美国洛杉矶都曾发生过严重的光化学烟雾时间,你认为主要是由于循环过程图中的 造成的。
(3)写出过程①所发生的化学反应方程式
。
(4)如果空气中同时含有较多的二氧化硫,那么,过程①引起的自然灾害是 .
(5)深入研究过程②的机理,对人工固氮有何积极意义 .
(6)过程⑦在地表上发生时,若人为地造成过程⑦过度的发生,会造成 ,常见的人为因素有 。看到的自然现象是 。
(7)根据氮在自然界的循环,分析人类在优化氮的循环,减少与之有关的自然灾害过程中可以做哪些工作 。
23.(8分)煤燃烧的反应热可通过一下两个途径来利用:a利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸汽反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在空气中充足的燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)=CO2(g) △H =E1 ①
b. C(s)+H2O(g)=CO(g)+H2(g) △H =E2 ②
H2(g)+1/2O2(g)=H2O(g) △H =E3 ③
CO(g) +1/2O2(g)=CO2(g) △H =E4 ④
请回答:
(1)与途径a想必,途径b有许多优点,即:
。
(2)上述四个热化学方程式中△H >0的反应使 (填反应序号)
(3)等质量的煤分别通过以上两条不同途径的可利用总能量关系正确的是 。
A.a比b多 B.a比b少 C.a与b在理论上相同
 (4)根据能量守恒定律,E1、E2、E3、E4之间的关系为
。
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为
。
22、(11分)已知①A、B、C、D、E为单质,其余为化合物;②常温下K为无色液体 ③D和Y既可以与X的水溶液反应,也能与Z的稀溶液反应;④常温下,可用C或D的容器贮运Z的浓溶液。它们之间的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)D的原子结构示意图为 。
(2)化合物M含有的化学键式 。
(3)D与X的水溶液反应的离子方程式是 。
(4)金属铜与Z的溶液反应的化学方程式是 。
(5)工业上制取B的化学方程式是 。
(6)实验测得的G的相对分子质量比理论值的的原因是
。
21.(8分)请将6种物质:Cl2、K2SO4、MnSO4、KmnO4、H2SO4、KCl分别填图下面对应的横线上,组成一个化学方程式并配平。
(1)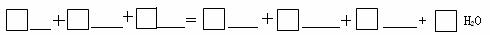
(2)反应种发生氧化还原反应的物质是(填化学式) ,氧化剂式 。
(3)由上述反应可知氧化性:KMnO4 Cl2(填>、<、=)。
(4)反应中0.2mol氧化剂完全反应需还原剂的质量为 g。
20.(10分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl
将所得碳酸氢钠晶体加热分解后即得到纯碱。请回答:
(1)工业所制得纯碱中常含有少量的氯化钠杂质,其原因是
。
(2)现有甲、乙、丙三个小组的的同学,欲测定某工业纯碱中碳酸钠的质量分数,分别设计并完成的实验如此下:
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重胃3.52g。
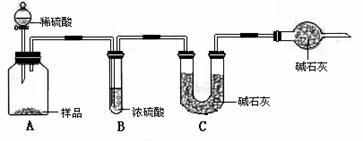
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2CaCl+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。
请分析、计算后填表:
|
分析与 计算分组 |
计算样品中碳酸钠 的质量分数 |
对实验结果 的评价 |
实验失败的主要原因 及对结果的影响 |
|
甲组 |
|
失败 |
|
|
乙组 |
|
成功 |
 |
|
丙组 |
|
成功 |
 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com