
25.(11分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验上学骤如下
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是____________。
(2)进行Ⅰ操作时,控制溶液pH=7-8
(有关氢氧化物沉淀的pH见下表)
|
氢氧化物 |
Fe(OH)3 |
AI(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致______溶解______沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料。先向沉淀物A中加入________填入物质的化学式),然后_____________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以特环使用的物质是_____________(填写物质化学式)。
(5)现设计一个实验,确定新产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③_____________④_____________⑤MgO称量
(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMO由此可知,产品的化学式中:
a=_________________________b=__________________________c=__________________
24.(11分)下图表示各物质之间的转化关系。已知:电石(CaC2)与水反应可制得乙炔,A、B、I都是XY2型化合物,且阴阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂,F与NaOH反应可用于制取禽流感,SARS等病毒的杀菌消毒剂。
请推断并按要求填空:
(1)G的电子式是____________;
(2)反应⑥的化学方程式是________________________;
(3)根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是____________;
(4)已知气体C的燃烧热是1300kJ/mol,表示气体C的燃烧的热化学方程式是________________________________________________________________________。
23.(11分)物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
(1)若X为氧化物,X 的化学式是______________________。
(2)若X为单质,X用于焊接钢轨时发生反应的化学方程式是______________________。
(3)若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
X与稀硫酸反应的离子方程式是____________________________________________;
X与足量稀氢氧化钠溶液反应的离子方程式是_________________________________。
①在宇航器中,可以不断地将座舱内的空气通过盛有金属 过氧化物(以过氧化钠为例)的容器,以除去A。反应的化学方程式是_________________________。
②科学家设计出新的航天飞机内的空气更新系统。其中一步是A和氢气在200~250℃时,镍催化作用下,生成甲烷和另一种物质。该反应的化学方程式是____________________。
22.(9分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物。XX′型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
已知,卤素互化物BrCl能发生下列反应 H2O+BrCl=HBrO+HCl KBr+BrCl=KCl+Br2
(1)写出IBr的电子式____________________。
(2)写出KI与IBr反应的化学方程式__________________,该反应中的所有反应物和生成物相比较,熔点最高的物质是___________(写化学式)。
(3)写出苯(C6H6)与BrCl发生取代反应生成一卤代物的化学方程式___________。
(4)如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是__________________________________。
21.(8分)三氧化硫的熔点是16.8℃,实验室合SO3的装置图。请回答下列问题:
(1)装置A的作用是_______________、_______________、___________________。
(2)反应进行一段时间后,C中可观察到的现象是___________________________。
(3)若将C换为E,实验过程中可观察到的现象是_______________这是因为_____________。
(4)使SO2和O2按体积比1∶1混合,且控制通入B的速率使之充分反应,由C导出的气体是____________________,气体存在的原因是_________________________________。
20.14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C,14N+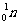 →14C+
→14C+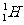 ,下列说法正确的是 ( )
,下列说法正确的是 ( )
A.14C和14N互为同位素
B.14C和C60是同素异形体
C.14CO2的摩尔质量为46
D.地球上活着的生物体内,由于新陈代射作用也存在14C
第Ⅱ卷 (非选择题共50分)
19.张老师做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成有少量KSCN和FeCl2溶液,溶液显红色。判断下列说法中正确的是 ( )
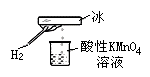 A.该条件下生成的水分子化学性质比较活泼
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了只具有氧化性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
16.已知:2Fe3++Cu→Cu2++2Fe2+。现有含有Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,且Fe与稀硝酸反应的还原产物仅为NO。若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
A.1︰1︰1
B.1︰3︰1
C.3︰3︰8
D.1︰1︰4
15.下列反应的离子方程式错误的是 ( )
A.向碳酸氢钙溶液中加入过量氢氧化钠
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
C.氢氧化铝与足量盐酸反应 Al(OH)3+3H+ =Al3++3H2O
D.过量CO2通入氢氧化钠溶液中 CO2+2OH-=CO32-+H2O
14.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述正确的是 ( )
A.NH4H是共价化合物 B.NH4H溶于水,所形成的溶液显碱性
C.NH4H与水反应时,水作还原剂 D.NH4H中的H元素只有一种化合价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com