
25.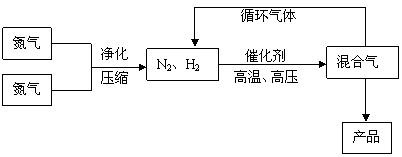 (10分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)
(10分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)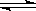 2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下:
2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下:
反应体系中各组分的部分性质见下表:
|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
24.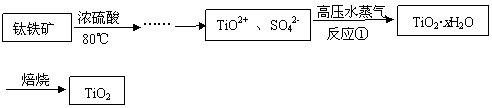 (10分)二氧化钛最重要的用途是用于制造钛的其他化合物。由二氧化钛直接制取金属钛是比较困难,原因是二氧化钛的热稳定性很强。例如:用碳还原二氧化钛,即使在高温1800℃也难反应。现用钛铁矿石为原料,经过一系列的反应制得颜料钛白粉(TiO2),其工业流程大致如下:
(10分)二氧化钛最重要的用途是用于制造钛的其他化合物。由二氧化钛直接制取金属钛是比较困难,原因是二氧化钛的热稳定性很强。例如:用碳还原二氧化钛,即使在高温1800℃也难反应。现用钛铁矿石为原料,经过一系列的反应制得颜料钛白粉(TiO2),其工业流程大致如下:
(1)反应①的离子方程式为 ,高压水蒸气的作用是 。
(2)用金红石主要成分(TiO2)制取颜料钛白粉(TiO2),涉及的工业流程大致如下:
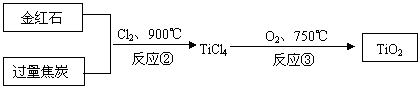
反应②的化学方程式 。
反应③的化学方程式 。
23.(10分)(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:
H2O2+2Fe3+=2Fe2++ O2↑+2H+, H2O2+ 2Fe2++2H+ =2Fe3++ 2H2O 。
在以上反应中Fe3+实际上起着 作用,总反应式为 。
(2) I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:
H2O2+I2=2HIO, 。
总反应式为 。
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为: 。
(4)铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是
。
(5)铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:
Fe2O3 + NaNO3 + NaOH → Na2FeO4 + NaNO2 + H2O
配平化学方程式,并标出电子转移的方向和数目。
Fe2O3 + NaNO3 + NaOH - Na2FeO4 + NaNO2 + H2O
22.(15分)某化学研究性学习小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜并测定样品中氧化铜的质量分数,其实验流程如下:
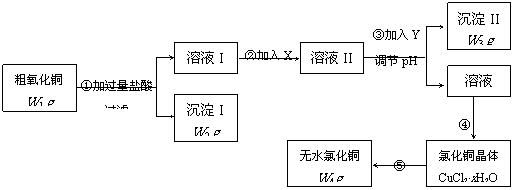

实验过程中的pH调节可参考下表:
|
物质 |
开始沉淀时的pH |
完全沉淀时的pH |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
回答以下问题:
(1)步骤①过滤操作中所用仪器有铁架台(带铁圈)、漏斗、烧杯等,还需要使用的仪器用品有 。
(2)步骤①中发生的离子反应方程式 。
(3)步骤②溶液I中加入X的目的是 。
(4)试剂Y可选用(填字母) ,选择的原因是
。
a.氢氧化钠 b.氨水 c.碱式碳酸铜 d.氧化铜
(5)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2·xH2O,其原因是
。
(6) 经检测,CuCl2·xH2O中含水28.6%,则CuCl2·xH2O中x的值为 。
(7)若步骤④中有80% 的氯化铜转入晶体,其余各步转化都是完全的,请根据流程图中表示的质量数据,写出样品中氧化铜的质量分数计算式 。
21.(15分)为了在实验室模拟用二氧化氮溶于水生成硝酸,现进行如下实验:
实验一:制备并收集一试管二氧化氮
 (1)实验室常用浓硝酸与铜反应制备二氧化氮,化学方程式是
。
(1)实验室常用浓硝酸与铜反应制备二氧化氮,化学方程式是
。
(2)可用右图装置制备并收集一试管二氧化氮,
① 在加入药品前,必须进行的操作是
。
② 该装置的缺点是(只填一个缺点既可) 。
实验二:尽可能多地使试管中的二氧化氮被水吸收
(3)将装有二氧化氮的试管A倒插入水中(图I),并轻轻晃动
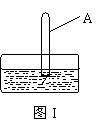 试管,观察到的现象是:
试管,观察到的现象是:
反应的化学方程式是 。
(4)从下图中挑选所需的仪器,完成制取O2,并将O2通入到上述实验后
的试管A中。
 ①画出制取O2装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明所用试剂。
①画出制取O2装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明所用试剂。
②某同学在图II的试管A内通入O2的过程中没有观察到液面上升,而是试管内充满了无色气体,主要原因是 。
20.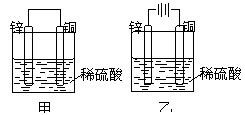 关于如图所示装置的叙述,正确的是[
]
关于如图所示装置的叙述,正确的是[
]
A.甲乙装置中锌片都作负极
B.甲乙装置中,溶液内的氢离子在铜片表面被还原
C.甲乙装置中,锌片上发生的反应都是还原反应
D.甲装置中,铜上有气泡生成,乙装置中铜片质量减少
第Ⅱ卷(共60分)
19.室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加水稀释2倍后,两溶液的pH均减小
B. 使温度都升高20℃后,两溶液的pH均不变
C. 加适量的醋酸钠晶体后,两溶液的pH均增大
D. 加足量的锌充分反应后,醋酸产生的氢气与盐酸一样多
18.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M电子层数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有[ ]
A. 能与水反应 B.能与氢氧化钠反应 C. 能与硫酸反应 D. 不能与碳酸钠反应
17. 常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是[ ]
A. pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B. pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C. pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
16.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
X |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是[ ]
A. 离子半径大小:r(M3+)>r(T2-) B. R的氧化物对应的水化物可能具有两性
C. X单质可在氧气燃烧生成XO3 D. L、X形成的简单离子核外电子数相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com