
18. (12分)做好环境消毒是预防“禽流感”的重要措施,某研究小组在实验室模拟制取漂粉精[主要成分为Ca(ClO)2],通过查阅资料知,“制备漂粉精为放热反应,70℃时,卤素和碱液还能发生反应:3X2+6OH-
5X-+XO3-+3H2O”。请根据所提供的实验装置,回答下列问题。
(12分)做好环境消毒是预防“禽流感”的重要措施,某研究小组在实验室模拟制取漂粉精[主要成分为Ca(ClO)2],通过查阅资料知,“制备漂粉精为放热反应,70℃时,卤素和碱液还能发生反应:3X2+6OH-
5X-+XO3-+3H2O”。请根据所提供的实验装置,回答下列问题。

(1)甲装置的U型管内发生反应的化学方程式为 。
(2)甲装置水槽中冷水的作用为 。
(3)上述甲、乙、丙、丁、戊五个装置,在制备过程中是否一定都需要?如果有不需要的,请指出并说明理由。
。
(4)请将你所选择的正确装置,按气流从左到右顺序组装好(填各导管口的字母) 。
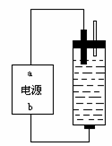 (5)该研究小组用100 mL 12 mol/L盐酸与8.7 g MnO2制备氯气,并将所得氯气与过量的石灰乳反应制取漂白粉,则理论上最多可制得Ca(ClO)2 克。
(5)该研究小组用100 mL 12 mol/L盐酸与8.7 g MnO2制备氯气,并将所得氯气与过量的石灰乳反应制取漂白粉,则理论上最多可制得Ca(ClO)2 克。
(6)如图,该研究小组还用石墨作电极电解饱和氯化钠溶液,制出了消毒液(主要成分为NaClO)。则b端应接电源的 极,理由是 。
应生成NaClO。
17.(10分)某学生向一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一 次):A.KI溶液、B.淀粉溶液、C.NaOH溶液、D.稀H2SO4、E.氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。依据溶液颜色的变化,回答下列问题:
(1)加入以上药品的顺序是(写序号): 。
(2)①→②反应的化学方程式为: 。
(3)溶液由棕黄色变为蓝色的原因是: 。
(4)③→④反应的化学方程式为: 。
(5)该学生又用Na2SO3来代替NaOH溶液做同样的实验,结果只做出前边四个实验现象,试分析不能实现④→⑤转化的原因: 。
16.向100mL的FeBr2溶液中,通入标准状况下Cl23.36L,Cl2全部被还原(2Fe2++Br2=2Fe3++2Br-),测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度是( )
A.0.75 mol•L-1 B.1.5 mol•L-1 C.2 mol•L-1 D.3 mol•L-1
第Ⅱ卷(非选择题 共86分)
15.有五列同族元素的物质,在101.3KP时测定它们的沸点(℃)如下表所示:
|
① |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
|
③ |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O 100.0 |
H2S -60.2 |
(d) -42.0 |
H2Te -1.8 |
|
⑤ |
CH4 -161.0 |
SiH4 -112.0 |
GeH4 -90.0 |
(e) -52.0 |
对应表中内容,下列各项中正确的是( )
A.a、b、c的化学式分别为Ne、Br2、HF
B.第②行物质均有氧化性;第③行物质对应水溶液均是强酸。
C.第⑤行各化合物中数据说明非金属性越强,气态氢化物沸点越高
D.第③行c的沸点较高,主要是由于分子间所形成氢键的影响
14.X、Y两种元素均为短周期元素,X元素的原子所具有的电子层数为其最外层电子数的二分之一,下列有关判断中,正确的是 ( )
A.X元素在周期表中的位置只能是第二周期第IVA族
B.若X的常见简单阴离子Xn-能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强
C.若Y的非金属性比X的强,则与同一种还原剂反应时,一个Y原子得到的电子数一定比一个X原子得到的电子数少
D.若X能形成XO32-、XO42-和X2O32-,Y能形成YO3-和YO4-,则X、Y一定在同一周期
13.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是 ( )
A.向CuSO4溶液中加入一小块金属钠
B.等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C.等物质的量的NaHCO3与Na2O2固体
D.在NaBr溶液中通入过量氯气
12.下列实验中操作错误的是( )
A.用稀盐酸清洗做焰色反应的铂丝
B.用酒精萃取碘水中的碘
C.氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
D.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
11.某无色溶液只可能含有I-、Fe3+、Na+、SO32-四种离子中的一种或几种,向该溶液中加
入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是( )
①肯定不含Fe3+;②肯定含I-;③可能含I-;④肯定含SO32-;⑤肯定含Na+;⑥可能含Na+
A.①③④ B.③④⑥ C.①②④ D.①③④⑤
10.在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应,放出大量气体,反应过程可表示如下:①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;②H2O2+I2=2HIO;③H2O2+2HIO=I2+O2↑+2H2O。则下列说法正确的是 ( )
A.H2O2在反应①中是还原剂
B.H2O2在反应②中既是氧化剂又是还原剂
C.上述反应说明了碘单质是过氧化氢分解的催化剂
D.上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是H2O2>HIO> I2
9.下列叙述不正确的是( )
A.NaCl和SiO2晶体熔化时,克服粒子间作用力的类型相同
B.CO2和CCl4分子中各原子最外层都满足8电子结构
C.分子晶体中一定含有共价键
D.在水溶液中能电离出自由移动的离子的晶体不一定是离子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com