
3.下列叙述中正确的是 ( )
A.CO2分子内含有极性键,所以CO2分子是极性分子
B.分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键
|
D.某非金属元素从游离态变成化合态时,该元素一定被还原
2.下列各组物质的分类都正确的是(括号里的是类别) ( )
A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(氧化性酸)、NaOH(强电解质)
C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)
1.下列有关叙述正确的是 ( )
A.“神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C. 赤潮、酸雨、臭氧层空洞、潮汐等都与环境污染有关
D. “冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
25.(10分)工业上电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L。将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%。计算:
(1)残液中氯化钠的质量分数(用含a、b、c的代数式表示)。
(2)残液中氢氧化钠的物质的量浓度(用含a、b、c、ρ的代数式表示)。
24.(8分) 0.02molKMnO4固体,加热一段时间后,收集到amol甲气体,在反应后的残留固体中加入足量的浓盐酸,继续加热,又收集到bmol乙气体,设此时Mn元素全部以Mn2+存在于溶液中。回答下列问题:
(1)甲气体是 (写化学式),a的最大值为 mol。
(2)a+b的最小值为 mol 。
23.(10分)有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素原子个数比 |
A∶C=1∶1 |
B∶A=1∶2 |
D∶E=1∶3 |
B∶E=1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。试回答下列问题:
(1)E在周期表中的位置 。
(2)向甲的水溶液中加入MnO2,反应的化学方程式: 。
(3)已知乙的相对分子质量小于甲。在实验室常用什么方法制得乙?(用化学方程式表示) 。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式是 。
(5)向30mL1mol/LKI溶液中依次注入下列试剂:①1mL5mol/L盐酸 ②0.5mol/L30%甲溶液 ③1mL丁。经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是 。
22.(8分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
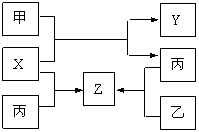 (1)若甲是短周期金属单质,乙、丙是短周期非金属单质。X、Y、Z中只有一种是离子
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质。X、Y、Z中只有一种是离子
晶体,试推断:
①含有丙元素的化合物是 (填X、Y、Z)
② 工业上有些气体中也含有一定量的Z成分,试列
举工业上含Z成分的气体 。
③ X与甲反应的化学方程式 。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常状况下
是深红棕色液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断甲、乙、丙三种物质的化学式 、 、 。
21.(10分)某化学研究性学习小组在研究 KClO3制取氧气实验时查得如下资料:
资料一:KClO3单独加热到363℃时熔融,在380℃时发生两个反应:
① 4KClO3 3KClO4+KCl;②
2KClO3
3KClO4+KCl;②
2KClO3 2KCl+3O2↑; 加热至400℃以上时KClO4 又发生分解,放出大量的O2。
2KCl+3O2↑; 加热至400℃以上时KClO4 又发生分解,放出大量的O2。
资料二:若用MnO2 作催化剂,则KClO3 在200℃时就能迅速分解,但制得的氧气中有氯气的气味,生成的氯化钾又略带紫红色,认为反应过程如下:
③ 2KClO3+2MnO2 2KMnO4+Cl2↑+O2↑;④ 2KMnO4
2KMnO4+Cl2↑+O2↑;④ 2KMnO4 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
⑤ Cl2+K2MnO4 2KCl+MnO2+O2↑;
2KCl+MnO2+O2↑;
资料三:部分物质的物理性质
|
物质 |
颜色和状态 |
密度/g·cm3 |
0℃时溶解度/g |
100℃时溶解度/g |
|
KCl |
无色晶体 |
1.98 |
27.6 |
56.7 |
|
KClO3 |
无色晶体 |
2.32 |
3.3 |
57 |
|
KClO4 |
无色晶体 |
2.52 |
0.75 |
21.8 |
请回答下列问题:
(1)在KClO3与KClO4中,热稳定性较好的是 。
(2)单独加热KClO3制取氧气,假设资料一中只发生反应①,则证明有KClO4 生成的实验方法是 。
(3)若用MnO2作催化剂制取氧气时,反应③中氧化产物是 (填化学式),按该反应过程,若制取1.5mol O2,总共有 mol电子发生转移。
(4)若用MnO2作催化剂加热KClO3时,两者质量比以MnO2占1/3为最好。若用占1/10的MnO2和KClO3共热时,开始放出氧气较慢,继续加热至一定温度时,放出氧气的速率会很快,其主要原因可能是 。
20.(10分)(1)氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“拟卤素”。它们阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出:
①(CN)2与KOH溶液反应的化学方程式 。
②KBr和KSCN的混合溶液中加入(CN)2反应的离子方程式为 _ 。
③硫氰酸(化学式为HSCN)有两种同分异构体。目前游离酸中的这两种互变异构体尚无法分离,硫氰酸易溶于水,其水溶液有强酸性。已知:硫氰酸中的碳、氮、硫原子在一条直线上,H、S、C、N的化合价分别为+1、-2、+4、-3。则硫氰酸的可能的结构式为______________________或___________________。
 (2)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX/
型卤素互化物与卤素单质结构相似、性质相近。如图是部分卤素单质和XX/型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是
,试推测ICl的沸点所处的最小范围
。
(2)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX/
型卤素互化物与卤素单质结构相似、性质相近。如图是部分卤素单质和XX/型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是
,试推测ICl的沸点所处的最小范围
。
(3)化合物BrFx与水按物质的量之比3:5发生反应,其产物为溴酸、氢氟酸、单质溴和氧气,则x= 。
19.(8分)下表是元素周期表中的一部分,表中所列字母分别代表一种元素。
|
a |
|
b |
|||||
|
|
|
|
d |
e |
f |
j |
|
|
c |
|
i |
g |
|
|
h |
|
(1)上述元素的单质中熔点最高的可能是 _____(填元素符号),形成的氧化物是原子晶体的元素是 _____(填元素符号)。
(2)dh4比gh4稳定,其原因是_________ ___________________。
(3)将少量的c投入i和 h所形成化合物的水溶液中,发生反应的离子方程式为:
__________________________________ ______。
(4)在发射“神舟”六号载人飞船的火箭推进器中,盛有分别由ae和af元素组成的两种液态化合物,它们的分子皆为18电子微粒,当它们混合反应时即产生e的单质和a2f。该反应的化学方程式为_________ ___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com