
1.市场上出现了各种各样的营养食盐,如:锌营养盐、钙营养盐 、硒营养盐、低钠营养盐、加碘食盐等十多种营养、保健盐。下列说法正确的是( )
A.加碘食盐是在食盐中加入了碘单质
B.钙营养盐是在食盐中加入了氯化钙或碳酸钙等含钙的化合物
C.低钠盐中的钠离子比氯离子少,所以低钠盐是一种带负电的物质
D.各类营养食盐的主要成分都是氯化钠
22.
 (12分)已知:4NH3 + 5O2
4NO + 6H2O ;4NO + 3O2 + 2H2O 4HNO3
(12分)已知:4NH3 + 5O2
4NO + 6H2O ;4NO + 3O2 + 2H2O 4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。请完成下列填空和计算:
(1)a molNO完全转化为HNO3需要氧气 a mol
(2)为使NH3恰好完全氧化为NO,氨气-空气混合物中氨的体积分数为(用小数表示)
(保留2位小数)
(3)20.0 mol的NH3用空气氧化,产生的混合气体为:NO 18.0 mol、 O2 12.0 mol、
 N2
150.0 mol和一定量的硝酸,以及其它成分。
N2
150.0 mol和一定量的硝酸,以及其它成分。
(高温下NO和O2不反应)则氨转化为NO和
HNO3的转化率分别为 、 。
(4)20.0 molNH3和一定量的空气充分反应后,再转
化成HNO3。
①在右图中画出HNO3的物质的量n(A)和空气
的物质的量n(B)关系的理论曲线。
②写出当125 mol≤n(B)≤200 mol时,n(A)和n(B)关系式 。
21. (10分)有如下化学反应:2A(g)+B(g)
2C(g);△H<0
(10分)有如下化学反应:2A(g)+B(g)
2C(g);△H<0
(1)若将4mol气体A和2mol气体B在2L密闭容器中混合,经2s后测得C的浓度为0.6mol·L-1。则2秒时B的浓度为 mol·L-1。
 (2)若把amol气体A和b mol气体B充入上述密闭容器,达到平衡时,它们的物质的量满足n(A)+n(B)=n(C),则气体A的转化率为
。
(2)若把amol气体A和b mol气体B充入上述密闭容器,达到平衡时,它们的物质的量满足n(A)+n(B)=n(C),则气体A的转化率为
。
(3)如右图所示,将4mol气体A和2mol气体B混
后置于体积可变的等压容器中,一定温度下达合
到平衡状态X时,测得气体总物质的量为4.2mol。
若A、B、C起始的物质的量分别用a、b、c表示,
试回答:
ⅰ:达到平衡状态X时的容器中,通入少量B气体,
容器中A的体积分数 (填“增大”、“减小”或“不变”)。若要使A的体积分数再升高到与平衡状态X相同,可采取的一种措施是 (只填一种即可)。
ⅱ:若起始a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态X相同,则起始时C的取值范围为 。
20.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的重要条件及生成的水已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常见的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应制得。(e)化合物J由两种元素组成,其相对分子质量为32。

请按要求填空:
(1)反应③的化学方程式 。
(2)C的结构式 ;H的化学式 。
(3)L溶液与化合物E反应的离子方程式 。
(4)化合物J的化学式 。
19.(8分)右图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
(1)③号元素位于周期表第__________周
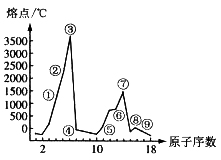 期____ ___族,其单质的一种同素
期____ ___族,其单质的一种同素
异形体能导电,该同素异形体的名称
叫______________。
(2)⑤、⑥两种元素形成的最高价氧化物
对应的水化物之间相互反应的离子方
程式为______________。
(3)⑦号元素的原子结构简图为___________。
(4)②、④两元素形成的化合物其晶体有两种结构,其中一种结构与金刚石相似,该结构的晶体属__________晶体,若使其熔化,需破坏的作用力为__________________。
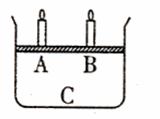
18.(14分)某研究性学习小组同学设计如图所示的实验装置来验证某些物质的化学性质,请回答:
(1)该实验的目的: 。
 (2)该实验的原理是(用化学方程式
(2)该实验的原理是(用化学方程式
回答) , 。
(3)实验用品:实验仪器除铁架台
(带铁夹)、储气瓶(两个)、直
管活活塞(K1、K2)、止水夹
(K3)、橡皮塞、橡皮导管和若干
玻璃导管外,还有那几种仪器
(写仪器名称) ,
实验所用的试剂为 。
(4)实验步骤:
①按图连接好仪器。
②打开活塞K1、K2,主要现象为 。
打开活塞K3,要使烧瓶内产生喷泉可采用的方法是 。
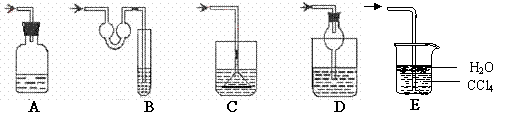
17.(8分)(1)以下各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的有__________

(2)对下列仪器:A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯
F、蒸发皿 G、分液漏斗使用时必须检查是否漏水的有 (填序号)
(3)用固体NaOH配制250mL0.5mol·L-1 NaOH溶液, 下列操作使所配制的NaOH溶液浓度偏高的有:______________(填写代号,选错倒扣分)
A.称取固体NaOH时未用小烧杯
B.没有用水冲洗烧杯2-3次
C.定容时,俯视液面使与刻度相切
D.溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度相切
E.将未冷却的溶液注入容量瓶后,马上定容
F.样品中混有Na2O杂质
16.假设原子晶体SiO2 中有25%的Si原子由Al原子取代,不足的价数由K原子补充,可形成正长石,则正长石的化学组成为 ( )
A.KAlSiO4 B.KAlSiO8 C.KAlSi3O8 D.KAlSi4O6
第Ⅱ卷(非选择题:共62分)
15.在标准状态下,将NO2、NO、O2混合后,充满容器倒置于水中,完全溶解,无气体剩余,若产物也不泄露,则所得溶液物质的量浓度的数值范围是 ( )
A. <c<
<c< B.
B.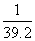 <c<
<c<
C.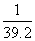 <c<
<c< D.
D. <c<
<c<
14.工业上用氨氧化法制得硝酸浓度一般为50%左右,若要得到更浓的硝酸,所采用的吸水剂是 ( )
A.浓硫酸 B.生石灰
C.无水CaCl2 D.硝酸镁晶体[Mg(NO3)2·6H2O]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com