
23.(11分)2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子--丁烯和乙烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
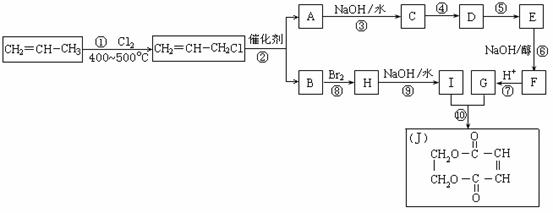
请按要求填空:
(1)写出下列反应的反应类型:
①:______________,⑥:______________,⑧:______________。
(2)反应②的化学方程式是___________________________________________。
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是______________________,物质E的结构简式是_______________________。
(4)反应⑩的化学方程式是___________________________________________。
22.(7分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。
(已知:2NO2
 N2O4;△H<0)
N2O4;△H<0)

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_________VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(2)若在A、B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率
αA将_________ (填增大或减小、不变);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将_________,B中NO2的转化率将_________(填:变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________。
21.(8分)⑴常温下取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合物中下列算式的精确计算结果(填具体数字):
c(Cl-)- c(M+)= mol/L,c(H+)- c(MOH)= mol/L。
⑵如果常温下取0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的PH<7,则说明MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3)弱酸的相对强弱可以用电离常数(K)表示。以HF为例,其电离常数的计算方法是:K=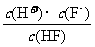 [c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度]。同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样。资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11。回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=
,c(OH-)= 。
[c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度]。同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样。资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11。回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=
,c(OH-)= 。
(4)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲 是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:________________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。

20、(8分)A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。
(1)写出E的电子式:_____________________。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:______________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:__________________。________极(填“阴”或“阳”)附近溶液由无色变为红色,其原因是:
___________________________________________________________________。
19.(6分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
⑴C、D组成的常见化合物,其水溶液呈碱性,原因是 ____________(用离子方程式表示)。
⑵D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式: ______ _________。
⑶A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2 g |
无其他物质 |
|
|
⑤ |
1.2 g |
CuO 0.5 g |
|
|
⑥ |
1.2 g |
MnO2 0.5
g |
|
回答下列问题:
⑶上述实验中的“待测数据”指__________;
⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是__________(填“酸式”或“碱式”)滴定管;
⑸若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上 单孔橡皮塞,
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.______,b.CuO的化学性质有没有改变。
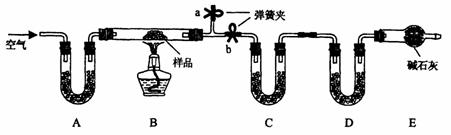
18..(12分)有一含NaCI、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
(1)加热前通入空气的目的是 ,
操作方法为
(2)装置A、C、D中盛放的试剂分别为 A , C , D
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCI含量将 填(“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;
若撤去E装置,则测得Na2CO3·10H2O的含量 。
(4)若样品质量为Wg,反应后C、D增加的质量分别为mlg、m2g,由此可知混合物中NaHCO3
质量分数为 。(用含w、mI、m2的代数式表示)
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是____(填实验序号),步骤①、③中研磨固体所用仪器的名称是___;
⑵步骤③中洗涤沉淀的操作是
17.(10分)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
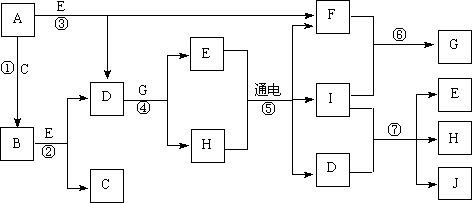
16.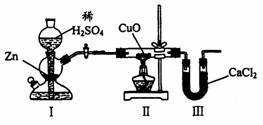 用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
A.I、Ⅱ装置之间缺少干燥装置
B.CuO没有全部被还原
C.Ⅱ装置中玻璃管内有水冷凝
D.Ⅲ装置后缺少干燥装置
第Ⅱ卷(非选择题共68分)
15.下列混合液中,各离子浓度的大小顺序正确的是
A.10ml.1mol/LNIH4Cl溶液与5mL0.2mol/LNaOH溶液混合,
c(Na+)>c(C1-)>c(OH-)>c(H+)
B.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2moL/LNaOH溶液混合,
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mLlmoL/L盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com