
5.下列离子方程式书写正确的是 ( )
A.硫酸亚铁溶液久置在空气中氧化变质:2Fe2++O2+4H+ 2Fe3++2H2O
B.澄清的石灰水和稀盐酸反应:Ca(OH)2+2H+ Ca++2H2O
|
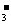 +OH-=CO
+OH-=CO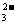 +H2O
+H2O
D.明矾溶液加热水解生成沉淀:Al3++3H2O Al(OH)3↓+3
H+
4.下列实验不能达到预期目的是 ( )
|
|
实验操作 |
实验目的 |
|
A |
向NaBr溶液中滴加新制氯水 |
比较Cl2与Br2的氧化性强弱 |
|
B |
用同一电路分别测定物质的量浓度相同的盐酸和某一元酸溶液的导电性 |
比较盐酸和该一元酸酸性的强弱 |
|
C |
分别向等物质的量的Al和Mg的固体加入过量的稀盐酸,测定产生气体的体积 |
比较镁与铝的金属性强弱 |
|
D |
常温下测定相同浓度的Na2CO3溶液和Na2SO4溶液的pH |
比较硫与碳的非金属性强弱 |
3.胶状液氢(主要成分是H2和CH4)有希望用于未来的运载火箭和空间运输系统。实验测
得:101kPa,1mol H2完全燃烧生成液态水,放出285.8kJ的热量;1 molCH4完全燃烧生
成液态水和CO2,放出890.3kJ的热量. 下列热化学方程式书写正确的是 ( )
A.CH2(g)+2O2(g) CO2(g)+2H2(l);△H=+890.3kJ·mol-1
B.CH4(g)+2O2(g) CO2(g)+2H2(l);△H=-890.3kJ·mol-1
C.CH4(g)+2O2(g) CO2(g)+2H2O(l);
△H=-890.3kJ
D.2H2(g)+O2(g) 2H2O(l); △H=-285.8kJ
2.纤维素被称为第七营养素,食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出的有害物质,从纤维素的化学成分看,它是一种 ( )
A.脂肪 B.氨基酸 C.多糖 D.单糖
1.下列树状分类法正确的是 ( )
A. B.
B.
|
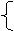
|
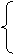
 C.化合物 D.
C.化合物 D.
24.
 (10分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
(10分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1) A和D氢化物中,沸点较低的是 (填“A”或“D”);
(2)
 A和B的离子中,半径较小的是 (填离子符号)。
A和B的离子中,半径较小的是 (填离子符号)。
(3) 元素C在元素周期表中的位置是 。
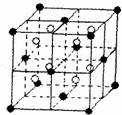
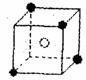
(4) A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。该化合物的电子式是
(5) 已知晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数。___________________________________________________________
23. (12分)在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如下图所示,请回答下列问题:

(1)实验开始时,仪器A中盛放电石,A中发生反应的化学反应方程式为
__________________________________________________________________________。
(2)B中应装____________,其作用是_____________________________________________。
(3)蒸馏烧瓶F中应先加入HgO,再从所给五种试剂中选取另外两种试剂直接加入烧瓶,请按加入的先后顺序写出另外两种试剂的名称____________ _____________。
(4)装置图中,加热F的方法叫_______,所选用温度计G的量程表示正确的是______(填代号)。
A.0℃-50℃ B.0℃-100℃ C.0℃-200℃ D.0℃-360℃
(5)检验乙醛已制出的操作及现象是_________________ _____ ____。
22.
(8分)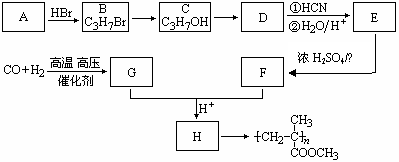 (12分)已知
(12分)已知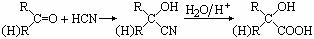 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成:
试写出:
(1)A、E的结构简式分别为: 、 。
(2)B→C、E→F的反应类型分别为: 、 。
(3)写出下列转化的化学方程式:C→D ;
G+F→H 。
21. (7分)某有机化合物A的分子式为C8H8O2,且分子中含有苯环。
(1)若A可以与NaHCO3溶液反应放出CO2,且苯环上只有一个侧链,则A的结构简式为
_________________。
(2)写出A属于酯类且可以发生银镜反应的所有同分异构体的结构简式。
____________________________________________________________________。
从上述同分异构体中任选一种,写出其发生银镜反应的化学方程式。
_____________________________________________________________________。
20.
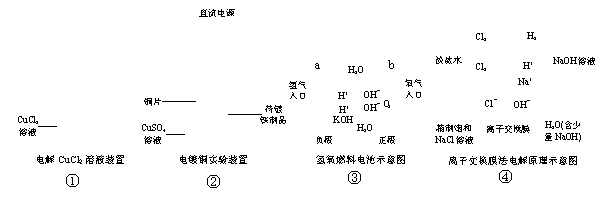
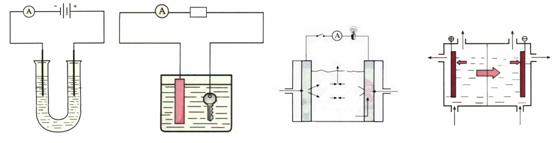 (12分)下面是常见的电化学装置图,①③④中均为惰性电极,请回答下列问题
(12分)下面是常见的电化学装置图,①③④中均为惰性电极,请回答下列问题
(1) 写出装置①中发生反应的总化学方程式_____________________________________。
(2) 装置②中铜片为_________极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为_________g。
(3) 装置③中b极为________极,该极的电极反应方程式为_______________________。
(4) 装置④为工业上电解食盐水制取NaOH的原理示意图,其中阳离子交换膜将电解槽隔成阳极室和阴极室,阳极室加入精制的饱和食盐水,阴极室加入纯水(含一定量的NaOH)。
请解释阴极的纯水中加入NaOH的原因:____________________________________
_______________________________________________________________________。
粗盐水中含有Ca2+、 Mg2+、 Fe3+ 、 SO42- 等杂质离子,一般用BaCl2、 Na2CO3、 NaOH等试剂使杂质成为沉淀除去,请按先后顺序写出发生反应的离子方程式。
(不考虑互促水解)(横线可不填满也可补充)
______________________________ __________________________________
______________________________ __________________________________
_______________________________ _________________________________。
然后加入盐酸调节盐水的pH ,所用盐酸可由电解食盐水的产物制取,若某厂日产50%的NaOH 4吨,试计算该厂理论上每天最多可以生产36.5%的盐酸_________吨。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com