
6.新型无机材料碳化钛(TiC),碳化硼(B4C3),氮化硅(Si3N4)等称为非氧化物陶瓷,合成这些物质需在高温条件下进行,在合成工艺中必须注意:
A. 通入充足的氧气 B. 避免与氧气接触
C. 可在氮气气氛中合成 D. 通入氟气
25.(5分)纳豆是一种减肥食品,从其中分离出一种由C、H、O三种元素组成的有机物A,为确定其结构进行如下各实验:
①6.0g物质A在一定条件下完全分解,生成3.36L(标准状况)一氧化碳和1.8gH2O。
②中和0.24g物质A,消耗0.20mol/L的氢氧化钠溶液20.00mL。
③0.01mol物质A完全转化为酯,需乙醇0.92g;0.01mol物质A能与足量钠反应放出0.336L标准状况下的氢气。
试确定:
(1)A的式量及化学式:
(2)A的结构简式。
 26.(7分)将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共A mol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOH B mol。(有关反应的方程式:①N2O4 2NO2;2NO2+2NaOH==NaNO2+NaNO3+H2O;③NO+NO2+2NaOH==2NaNO2+H2O)
26.(7分)将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共A mol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOH B mol。(有关反应的方程式:①N2O4 2NO2;2NO2+2NaOH==NaNO2+NaNO3+H2O;③NO+NO2+2NaOH==2NaNO2+H2O)
(1)若A=0.8,则原0.8mol混合气体能否被烧碱溶液完全吸收?若能,当B=1.0时,原0.8mol混合气体中各气体的物质的量为多少?若不能,该问不用回答。
(2)若仅已知A=0.8,试求B值的范围.
(3)求A=0.8时,气体与碱反应所得溶液中NaNO3的物质的量(可用含有关字母的代数式表示)。
 23.(5分)如下图所示,温度不变时某容器分隔A、B两部分,A容积固定不变,B有可移动的活塞,现有A中充入2molSO2和1molO2,在B中充入
23.(5分)如下图所示,温度不变时某容器分隔A、B两部分,A容积固定不变,B有可移动的活塞,现有A中充入2molSO2和1molO2,在B中充入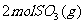 和
和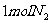 ,在相同条件下发生可逆反应:2SO2+O2 2SO3(g)
,在相同条件下发生可逆反应:2SO2+O2 2SO3(g)
|
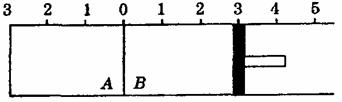
根据下列要求填写空白:
(1)若固定活塞位置在右侧的3处不动,达到平衡时,设A中压强pA,B中压强为pB,则pB,与pB的关系是pA pB(填“大于”“小于”或“等于”)。
(2)若要使B中与A中平衡状态相同,可移动活塞的位置应在 处。(选“2”、“3”或“4”)
(3)若活塞右移到5处,达到平衡后,A中SO3(g)为xmol,B中SO3(g)为ymol,则x和y的关系是x y(填“大于”“小于”或“等于”),理由是 。
24.(10分)相对分子质量为94.5的有机物A,在一定条件下可以发生如下图所示的转化(其他产物和水已略去);
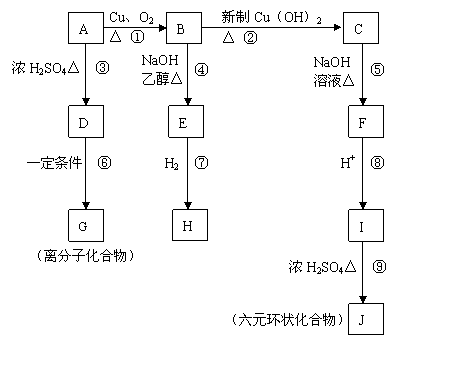
请回答下列问题:
(1)写出下列物质的结构简式:A ,J 。
(2)上述①-⑨的反应中, 是取代反应(填编号), 是消去反应(填编号)。
(3)写出下列反应的化学方程式:
B→C 。
B→E 。
D→G 。
(4)有机物I在一定条件下可合成一种环保开支高分子材料,则该高分子结构简式为
。
22.(7分)有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH ,加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀
的量如图下所示:
,加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀
的量如图下所示:
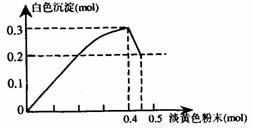
根据题意回答下列问题:
(1)淡黄色粉末为 (填名称)
(2)溶液中肯定有 离子,肯定没有 离子。
(3)溶液中离子的物质的量之比为 。
(4)写出下列方程式:
①淡黄色粉末与水反应的化学方程式: 。
②刺激性气味的所体产生的离子方程式: 。
③沉淀部分减少时的离子方程式: 。
21.(6分)已知某溶液中只存在OH-、H+、NH 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
①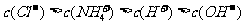 ②
②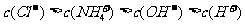
③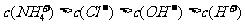 ③
③
(1)若溶液中只溶解了一种溶质,则该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是 (填序号);
(2)若上述关系中③是正确的,则溶液中溶质的化学式是 ,若上述关系中④是对的,则溶液中溶质的化学式是 。
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
c(NH3·H2O),混合前盐酸中c(H+)和氨水中c(OH-)的关系c(H+)
c(OH-)。(填“大于”、“小于”或“等于”)
20.(8分)某一化学反应的实验装置如图所示:
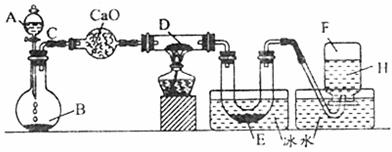
A-H属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氯水、水、锌粒、铜片、氯化钙、氧化钙、四氧化三铁、氧化铜、氢气、二氧化碳、二氧化氮、氯气、氯化氢、氨气、氮气、氧气。
实验现象:①D物质由黑色变为红色;②无水硫酸铜粉末放入无色透明的E中得到蓝色深夜;③点燃的镁条伸入无色无味的F中,镁条继续燃烧,将生成的物质放入水中,有气体放出,并有白色浑浊物形成,该气体具有刺激性气味,并能使润湿的红色石蕊试纸变蓝。通过分析回答:
|
A ;B ;D ;E ;F 。
(2)写出有关的化学方程式:A与B ;C与D ;F与Mg的反应产物与水 。
19.(4分)下列实验操作或对实验事实的叙述正确的是 (填序号)
①用稀HNO3清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00mL 0.1000mol/L的KMnO4溶液;
④用托盘天平称取10.5g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融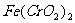 和
和 固体混合物;
固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备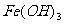 胶体;
胶体;
⑧配制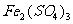 饱和溶液时,加入少量的稀硫酸.
饱和溶液时,加入少量的稀硫酸.
18.在100mL NaOH溶液中加入NH4NO3和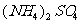 固体混合物,加热充分反应,加入的混合物质量和产生的气体的体积(标准状况)关系如图,当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标准状况)是( )
固体混合物,加热充分反应,加入的混合物质量和产生的气体的体积(标准状况)关系如图,当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标准状况)是( )
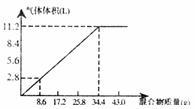
A.5.68L B.14.68L C.15.68L D. 14.68L
第Ⅱ卷(非选择题,共52分)
17.在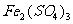 溶液中,加入ag铜,完全溶解后,再加入bg铁,充分反应后得到cg残余固体,且
溶液中,加入ag铜,完全溶解后,再加入bg铁,充分反应后得到cg残余固体,且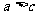 ,则下列说法正确的是 ( )
,则下列说法正确的是 ( )
A.残余固体全部是铜
B.最后得到的溶液中一定含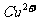
C.将残余固体加入到稀H2SO4中,有气泡产生
D.最后得到的溶液中可能含有Fe3+
16.2004年美国圣路易斯大学科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍,且安全,电池总反应为: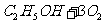 ==
== ,电池示意图如图所示。下列说法不正确的是 ( )
,电池示意图如图所示。下列说法不正确的是 ( )
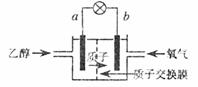
A.a极为电池的正极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应:
D.设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6NAq库仑的电量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com