
28.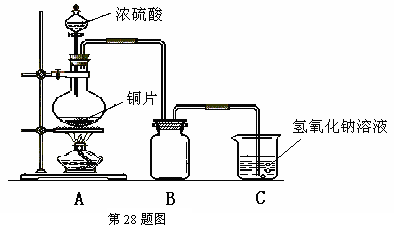 (18分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
(18分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
⑴B是用来收集实验中产生的气体的装置,但未将导管画全,请在答题卡上相应图中把导管补充完整。
⑵实验中他们取6.4 g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是:_______________________________________________________________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:______________(填写字母编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
⑶为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是_________________(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥,称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥,称量沉淀
②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测出消耗NaOH溶液的体积来求余酸的物质的量浓度。
假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量的浓度_______(填“能”或“否”),其理由是________________________ ____________________________________________。
(4)请再设计一个可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)。
27.(14分)已知A为酸式盐,B为某二价主族金属(其原子序数不超过20)的化合物,常温常压下C、D、F、G、I均呈气态,H为无色液体。等物质的量的A、B充分混合后加热能恰好完全反应(如下图所示),E的式量为100,G的式量比F大16。图中反应条件(除加热外)均已略去。
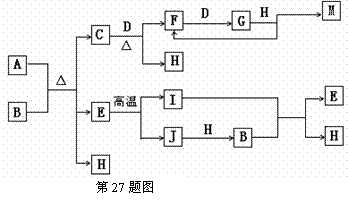
⑴写出B的电子式________________ I的结构式 。
⑵写出下列反应的离子方程式:
①向A溶液中加入过量的NaOH溶液,并加热 ,
②气体I通入B溶液中 ,
⑶写出C和D反应的化学方程式 .
⑷如对盛有气体G的密闭容器(带可移动的活塞)进行压缩操作,产生的现象是______ ____________________________________ ,原因是_______________________________ _____________________________________________________________________。
26.(16分)已知A、B、C、D均为短周期元素,且原子序数依次递增;A、B、C三种元素的核电荷数之和等于D元素的核电荷数,且D元素的核电荷数为C的2倍;C、D两元素同主族,且能在一定条件下发生下面两个反应
①化合物(只含A、B)跟化合物(只含B、C)按物质的量比2:3反应生成单质(含B)和化合物(只含A、C)
②化合物(只含A、D)跟化合物(只含C、D) 按物质的量比2:1反应生成单质(含D)和化合物(只含A、C)
请通过分析后回答:
⑴B元素的名称是________________,C元素的原子结构示意图为__________________
⑵D元素最高价氧化物的水化物的化学式是_______,反应①中的化合物(只含A、B)分子的空间构型为____________________
⑶反应②的化学方程式为______________,其中每生成单质D 32g,反应中有_____ mol电子转移。
⑷含有这四种元素(四种元素都含有)的各种化合物中,相同浓度下,溶液的pH最小的化合物的化学式为_________,该化合物的晶体中阳离子与阴离子的个数比为___________________。
13.下列反应中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是:
A. NH4Cl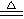 NH3↑+ HCl↑ B. Na2CO3+CO2+H2O=2NaHCO3
NH3↑+ HCl↑ B. Na2CO3+CO2+H2O=2NaHCO3
C. 2NaOH+Cl2 =NaCl+NaClO+H2O D. 2 Na2O2+2CO2=2Na2CO3+O2
第II卷(非选择题,共174分)
12.下列反应的离子方程式正确的是:
A. 用惰性电极电解MgCl2溶液:2Cl-+2H2O 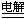 Cl2↑+H2↑+2OH -
Cl2↑+H2↑+2OH -
B. 向次氯酸钙溶液中通人过量CO2:ClO-+CO2+H2O = HClO+HCO3-
C. 小苏打溶液与甲酸溶液混合:HCO3-+H+ = H2O+CO2↑
D. 硫酸亚铁溶液中加入H2O2溶液:Fe2++H2O2+2H+ = Fe3++2H2O
11.下列除去杂质的方法正确的是
A. 除去FeCl2溶液中的少量FeCl3: 加入足量铁屑,充分反应后过滤
B. 除去CO2中的少量HCl: 通入Na2CO3溶液,收集气体
C. 除去N2中的少量O2: 通过灼热的CuO粉末,收集气体
D. 除去KCl溶液中的少量MgCl2: 加入适量NaOH溶液,过滤
10.下列各组顺序不正确的是:
A. 粒子半径:S2- > Cl - > F - > Na+ > Mg2+
B. 热稳定性:SiH4 < PH3 < NH3 < H2O < HF
C. 熔点: SiO2 > NaCl > 干冰 > 碘 > 臭氧
D. 还原性:HF < HCl < HBr < HI < H2S
9.下列能够使反应 :Cu+2H2O=Cu(OH)2+H2↑ 获得成功的是:
A. 铜片作原电池的负极,碳棒作原电池的正极 ,氯化钠作电解质溶液
B. 铜--锌合金在潮湿的空气中发生电化学腐蚀
C. 用铜片作阴、阳电极,电解氯化钠溶液
D. 用铜片作阴、阳电极,电解硫酸铜溶液
8.已知C3N4晶体具有比金刚石还大的硬度,且每个原子的最外层均满足8电子结构。下列关于C3N4晶体的说法正确的是:
A. C3N4晶体可能是分子晶体,晶体中微粒间通过共价键相结合
B. C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
C. C3N4晶体中,C-N键的键长比金刚石中C-C键的键长要长
D. C3N4晶体中每个氮原子上还有2对未共用电子
7.下列说法或表示方法中正确的是:
A. 等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B. 氢气的燃烧热为285.8kJ · mol-1,则氢气燃烧的热化学方程式为
2H2(g) + O2(g) = 2H2O(l);△H=-285.8 kJ· mol-1
C. Ba(OH)2 · 8H2O(s) + 2NH4Cl(s) = BaCl2(s) + 2NH3(g) + 10H2O(l);△H<0
D. 已知中和热为57.3 kJ · mol-1,若将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量要大于57.3 Kj
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com