
5. 食品中含有过量的 (丙烯酰胺)可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:①能使酸性高锰酸钾溶液褪色,②能发生加聚反应,③能与氢气发生加成反应, ④是高分子化合物。其中正确的是
A.①②④ B.②③④ C.①②③ D.①③④
4. 金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关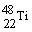 和
和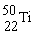 的说法中正确的是
的说法中正确的是
A.
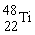 和
和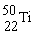 原子中均含有22个中子
原子中均含有22个中子
B.
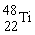 和
和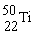 在周期表中位置相同,都在第4纵行
在周期表中位置相同,都在第4纵行
C.
分别由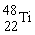 和
和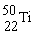 组成的金属钛单质互称为同分异构体
组成的金属钛单质互称为同分异构体
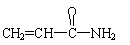 D.
D.
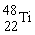 与
与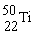 为同一核素
为同一核素
3.巴豆酸的结构简式为CH3CH=CHCOOH ,现有
①水 ②溴的四氯化碳溶液 ③丁醇
④纯碱溶液 ⑤酸性KMnO4溶液。
在一定条件下,能与巴豆酸反应的物质组合是
A.只有②④⑤ B.只有②③⑤
C.只有②③④⑤ D.①②③④⑤
2. NA为阿伏加德罗常数,下列说法中正确的是
A.用稀氢氧化钠溶液吸收氯气22.4L,反应中转移的电子数目为NA
B. 1mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA
C. 室温下,28.0g乙烯和丙烯混合气体中含有的碳原子数为2NA
D. 标准状况下11.2L臭氧中含有的氧原子数目为3NA
1.下列叙述不正确的是
A.金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料
B.水晶和玛瑙的主要成分都是SiO2
C.含硅的钢具有良好的导磁性
D.太阳能电池可用硅材料制作,其应用有利于环保、节能
24.
 (10分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
(10分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1) A和D氢化物中,沸点较低的是 (填“A”或“D”);
(2)
 A和B的离子中,半径较小的是 (填离子符号)。
A和B的离子中,半径较小的是 (填离子符号)。
(3) 元素C在元素周期表中的位置是 。
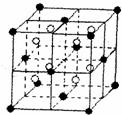
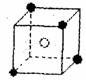
(4) A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。该化合物的电子式是
已知晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数。___________________________________________________________
23. (12分)在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如下图所示,请回答下列问题:
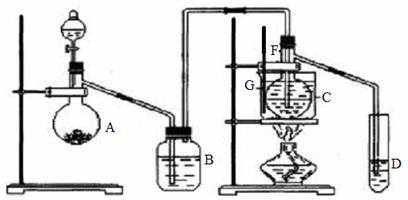
(1)实验开始时,仪器A中盛放电石,A中发生反应的化学反应方程式为
__________________________________________________________________________。
(2)B中应装____________,其作用是_____________________________________________。
(3)蒸馏烧瓶F中应先加入HgO,再从所给五种试剂中选取另外两种试剂直接加入烧瓶,请按加入的先后顺序写出另外两种试剂的名称____________ _____________。
(4)装置图中,加热F的方法叫_______,所选用温度计G的量程表示正确的是______(填代号)。
A.0℃-50℃ B.0℃-100℃ C.0℃-200℃ D.0℃-360℃
(5)检验乙醛已制出的操作及现象是_________________ _____ ____。
22.
(8分)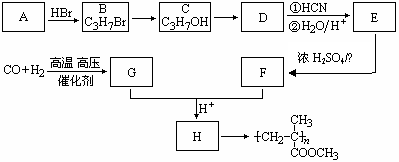 (12分)已知
(12分)已知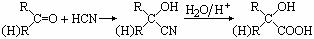 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成:
试写出:
(1)A、E的结构简式分别为: 、 。
(2)B→C、E→F的反应类型分别为: 、 。
(3)写出下列转化的化学方程式:C→D ;
G+F→H 。
21. (7分)某有机化合物A的分子式为C8H8O2,且分子中含有苯环。
(1)若A可以与NaHCO3溶液反应放出CO2,且苯环上只有一个侧链,则A的结构简式为
_________________。
(2)写出A属于酯类且可以发生银镜反应的所有同分异构体的结构简式。
____________________________________________________________________。
从上述同分异构体中任选一种,写出其发生银镜反应的化学方程式。
_____________________________________________________________________。
20. (12分)下面是常见的电化学装置图,①③④中均为惰性电极,请回答下列问题
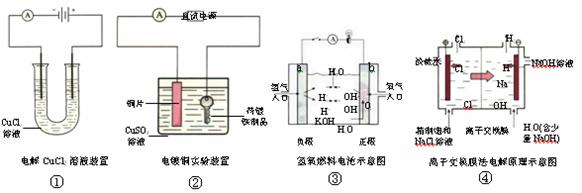
(1) 写出装置①中发生反应的总化学方程式_____________________________________。
(2) 装置②中铜片为_________极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为_________g。
(3) 装置③中b极为________极,该极的电极反应方程式为_______________________。
(4) 装置④为工业上电解食盐水制取NaOH的原理示意图,其中阳离子交换膜将电解槽隔成阳极室和阴极室,阳极室加入精制的饱和食盐水,阴极室加入纯水(含一定量的NaOH)。
请解释阴极的纯水中加入NaOH的原因:____________________________________
_______________________________________________________________________。
粗盐水中含有Ca2+、 Mg2+、 Fe3+ 、 SO42- 等杂质离子,一般用BaCl2、 Na2CO3、 NaOH等试剂使杂质成为沉淀除去,请按先后顺序写出发生反应的离子方程式。
(不考虑互促水解)(横线可不填满也可补充)
______________________________ __________________________________
______________________________ __________________________________
_______________________________ _________________________________。
然后加入盐酸调节盐水的pH ,所用盐酸可由电解食盐水的产物制取,若某厂日产50%的NaOH 4吨,试计算该厂理论上每天最多可以生产36.5%的盐酸_________吨。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com