
17.Ⅰ(4分)下列有关化学实验的基本操作及安全知识的叙述,错误的是 (填序号)。
A.用托盘天平称取10.50 g干燥的NaCl固体
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方,
C.测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液
D.中和热的测定实验中,可用金属丝(棒)代替环形玻璃棒
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
G.采取降温结晶可以提纯混有少量氯化钠的硝酸钾
 H.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
H.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
Ⅱ(6分)右图是某学校实验室从化学试剂商店买回的硫酸试剂 标签上的部分内容。某次学生实验需要0.5mol/LH2SO4溶液480ml,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
①实验中除了量筒、烧杯外还需要的其它仪器有: ;
②计算所需浓硫酸的体积是 mL;若该硫酸与等体积的水混合时,所得溶液中溶质的质量分数 49%(填写“<”、“=”或“>”);
③配制过程中需先在烧杯中将浓硫酸进行稀释。稀释时操作方法是: ;
16、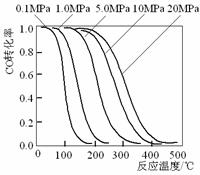 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO-ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO-ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2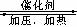 CH3OH,工艺中一些参数如右图;目前正在开发的新法是:2CH4+ O2
CH3OH,工艺中一些参数如右图;目前正在开发的新法是:2CH4+ O2 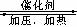 2CH3OH 。下列关于新法和旧法的说法正确的是
2CH3OH 。下列关于新法和旧法的说法正确的是
A.旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应
B.旧法生产中,选择合适催化剂时,可推测高压法合成比低压法合成更有发展优势。
C.新法与旧法相比,原料丰富并可直接从天然气中获得
D.新法生产中,需控制V(CH4)/V(O2)=9∶1,目的是提高空气中氧气的转化率
第II卷(非选择题,共86分)
15.某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(0H-)>c(H+),该溶液可能是
A.由pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合而成
B.由1 mL0.1 mol·L-1的CH3COOH溶液与10 mL 1 mol·L-1的NaOH溶液混合而成
C.由0.1mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合而成
D.由0.1 mol·L-1的CH3COONa溶液与0.1 mol·L-1的NaOH溶液等体积混合而成
14.中科大陈乾旺教授等人发现合成金刚石的新方法,其化学原理为:
①Na+CO2  C(金刚石)+C(石墨)+Na2CO3(未配平)。该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是:
C(金刚石)+C(石墨)+Na2CO3(未配平)。该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是:
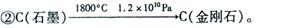
以下有关表述中正确的是
A.反应①和②都存在旧化学键的断裂与新化学键的形成
B.新法利用的是化学变化,旧法利用的是物理变化
C.在反应①中每生成12g金刚石需要消耗23g金属钠
D.反应①和②中,金刚石都是还原产物,Na2CO3是氧化产物
13.碱性电池具有容量大、放电电流大的特点,因而得到广泛的应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O=Zn(OH)2(s)+Mn2O3(s)。下列说法正确的是
A、电池工作时,锌为正极
B、电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
C、电池工作时,电子有正极通过外电路流向负极
D、外电路中每通过0.2mol电子,锌的质量理论上减小13g
12.在乙离子存在的情况下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙能够对甲离子进行成功检验的是(说明:在实验过程中不允许加热、过滤、等操作)
|
选 项 |
试 剂 丙 |
甲 离 子 |
乙 离 子 |
|
A |
稀盐酸、BaCl2溶液 |
SO42- |
SO32- |
|
B |
AgNO3溶液 |
Cl- |
SO42- |
|
C |
KSCN溶液 |
Fe2+ |
Fe3+ |
|
D |
NaOH溶液 |
Al3+ |
Mg2+ |
11.化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。但类比是相对的,如根据2Na2O2+2CO2= Na2CO3+ O2, 类推2Na2O2+2SO2= Na2SO3+ O2是错误的,应该是Na2O2+SO2= Na2SO4。下列各组类比中正确的是
A.由NH4Cl NH3↑+HCl↑,推测:NH4I
NH3↑+HCl↑,推测:NH4I NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO,推测:CO2+NaClO+H2O=NaHCO3+HClO
D.由Na2SO3+2HCl=2NaCl+H2O+ SO2↑,推测:Na2SO3+2HNO3=2NaNO3+H2O+ SO2↑
10.下列各组离子,在指定的环境中一定能大量共存的是
A.在pH为7的溶液中:Ag+、K+、SO42-、Cl-
B.在能使pH试纸变深蓝色的溶液中:Na+、S2-、NO3-、CO32-
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
D.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
9.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中不正确的是
A.将162.5g FeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数小于6.02×1023
B.在含196g H2SO4的浓硫酸溶液中加入足量的锌粉使其充分反应,则反应结束时,转移电子数约为4×6.02×1023个
C.标准状况下,22.4 L CO2和CO混合气体中含有的碳原子数约为6.02×1023
D.常温常压下,0.1 mol Fe在0.1 mol C12中充分燃烧,转移的电子数约为l.806×1023
8.已知:101 k Pa时辛烷的燃烧热为5518 kJ · mol-1,强酸和强碱在稀溶液中发生反应时的中和热为57.3 kJ · mol-1,则下列热化学方程式书写正确的是
① 2C8H18( l ) + 25O2(g) = 16CO2(g)+ 18H2O(g);△H = -11 036 kJ · mol-1
②2C8H18( l ) + 25O2(g) = 16CO2(g)+ 18H2O(l);△H = -11 036 kJ· mol-1
③ H+ + OH- = H2O;△H = -57.3 kJ · mol-1
④ 2NaOH(aq)+ H2SO4(aq)= Na2SO4(aq)+2 H2O(l);△H =-114.6 kJ · mol-1
A.①③ B.②④ C.②③ D.只有②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com