
22.(8分)某烃A的相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在-定条件下氧化只生成C,C能使石蕊试液变红。已知:

试写出:
⑴A的分子式 。
⑵化合物A和C的结构简式:A ;C 。
⑶与C同类的同分异构体(含C)有 种。
21.(8分) 下图为某些常见物质之间的转化关系。已知:A、B、I中含有相同的阳离子且都是XY2型化合物,I是常用的干燥剂,C为直线型分子。
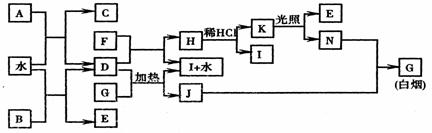
请按要求填空:
(1)B的电子式是 ,K的结构式是 ;
(2)D与G反应的化学方程式是 ;
(3)单质F与D的反应在工业上有重要的用途,其化学方程式是
。
20. (9分)某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下

依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀)。原因是 (填序号,下同)
(a)减少过程中产生NOX的量 (b)减少原料银的消耗量 (c)节省硝酸物质的量
(2)步骤B加热保温的作用是 .
(a)有利于加快反应速率
(b)有利于未反应的硝酸挥发
(c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是
(a)置换反应 (b)水解反应 (c)氧化还原反应
产生的沉淀物化学式 .
19.(12分)硼酸晶体呈片状,有滑腻感,可作润滑剂,硼酸对人体的受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
⑴从题目信息可知硼酸应属于 酸(填强、中强、弱);
⑵硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为: ;
⑶研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层具有达到8电子稳定结构的趋向。已知0.01mol硼酸可以被20mL 0.5mol·L -1NaOH溶液恰好完全中和,据此推测硼酸在水溶液中呈酸性的原因是(用离子方程式表示、酸根离子用结构式表示) ;
写出硼酸与NaOH溶液反应的化学方程式: ;
⑷硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的方程式: ;
 ⑸科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。
⑸科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。
根据右图确定硼化镁的化学式为 。
18.(14分) I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式
。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:

⑴乙醇发生催化氧化的化学反应方程式为 。
⑵实验时,常常将甲装置浸在70℃-80℃的水浴中,目的是 ____;由于装置设计上的缺陷,实验进行时可能会 ____________
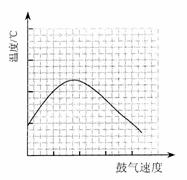
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。
试解释鼓气速度过快,反应体系温度反而下降的原因: ________________________ ;你认为该实验中“鼓气速度”这一变量可用 来计量___________。
17. (8分) ①实验室可利用下图1所示装置来制取气体 (写出两种常见气体的化学式);②已知草酸(乙二酸)在受热时发生如下分解反应:H2C2O4 CO+CO2+H2O 。某同学拟用图1的改进装置图2来验证上述反应中有CO2和H2O生成。已知:草酸晶体的化学式为:H2C2O4·2H2O,熔点为100.1℃,分解温度约为170℃-180℃。试结合所学知识,分析该实验设计中的不足之处(至少指出3处)
。


图1 图2
16. 某硝酸盐受热分解的产物为金属氧化物和NO2、O2。下列相关叙述正确的是
A.分解产生的气体能使余烬木条复燃,证明其中含有氧气
B.若分解的固体产物全为CuO,则产生的混合气体从理论上说可恰好完全溶解于水
C.若产生NO2和O2的物质的量之比为6:1,则金属元素在分解过程中化合价降低
D.若3.76g Cu(NO3) 2无水晶体受热分解,得到1.52g固体,则固体中有Cu2O 0.72g
第Ⅱ卷(非选择题 共86分)
15.1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如下图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是
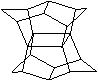 A.一氯代物的同分异构体只有3种
A.一氯代物的同分异构体只有3种
B.分子中含有二个亚甲基(-CH2-)
C.分子中含有4个五元碳环
D.分子式为C20H20
14. 设No为阿伏加德罗常数的值,下列叙述中不正确的是
①12.4g白磷晶体中含有的P-P键数是0.6No
②电解精炼铜时转移了No个电子,阳极溶解32 g铜
 ③100g的98%的浓H2SO4中所含的氧原子数为4No
③100g的98%的浓H2SO4中所含的氧原子数为4No
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2No
⑤2.9g 2CaSO4·H2O含有的结晶水分子数为0.02No
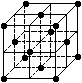
⑥C60晶胞结构如右图所示,720gC60晶体含1NA个晶胞
⑦含1mol FeCl3饱和溶液加入到沸水形成氢氧化铁胶体,胶体微粒数目约为No
A.②③⑤⑥⑦ B.①③④⑤⑥ C.①②③④⑤ D.③④⑤⑥⑦
13. 金刚烷(C10H16)是一种重要的脂环烷烃,其结构高度对称,如下图所示。金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷(C10H14ClBr)的同分异构体数目是
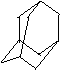 A.4种
B.6种 C.8种 D.10种
A.4种
B.6种 C.8种 D.10种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com