
7.下列叙述不正确的是
A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
B.将Cl2和SO2分别通入到品红溶液中,均能使品红溶液退色
C.反应AgCl + NaBr AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
6.利用相关数据作出的推理或判断不正确的是
A.用键能大小的数据,可判断分子的稳定性
B.用原子半径的数据,可推断元素的主要化合价
C.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来
D.用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3
5.教材是学习的重要材料,但不能迷信教材。下列是中学化学教材中摘录的部分表述内容,根据你所学的化学知识判断,其中不够科学严密的是
A.第一册教材P101:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
B.第一册教材P17:离子方程式不仅可以表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应。
C.第三册教材P20:除了加入电解质可使某些胶体聚沉外,将两种带相反电荷的胶体混合,也能发生聚沉。
D.第二册教材P34:不同的化学反应,具有不同的反应速率,这说明,参加反应的物质的性质是决定化学反应速率的重要因素。
4.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化
D.食盐和葡萄糖分别溶解在水中
3.下列反应中,氧化产物是有色单质的是
A.2NO+O2=2NO2 B.CuCl2+Zn=Cu+ZnCl2
C.2KI+Br2=2KBr+I2 D.NaH+H2O =NaOH+H2↑
2.亚硝酸盐中毒,又名乌嘴病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法不正确的是
A.在中毒过程中血红蛋白被氧化
B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性
D.解毒时高铁血红蛋白被还原
1.据报道,科学家已成功合成了少量O4,有关O4的说法正确的是
A.O4与O3、O2是同素异形体 B.O4比O2稳定
C.等质量的O4与O3含原子个数比为4:3 D.O4的摩尔质量是64g
25.(10分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
I.⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________,反应的离子方程式为_________________________________。
⑶实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

⑴图中OC段没有沉淀生成,此阶段发生反应的离子方程式为_____________________。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________;上述现象说明溶液中_____结合OH-的能力比___强(填离子符号)。
(3)B与A的差值为_________mol。
⑷B点对应的沉淀的物质的量为______mol,C点对应的氢氧化钠溶液的体积为_______mL
24. (7分)马来西亚盛产锡器(原料是锡、铜的合金,其中锡的质量分数在95%-98%之间。锡,Sn,位于元素周期表中的第五周期第ⅣA族)。由于其独特的生产工艺,马来西亚生产的锡器不但外形美观,做工精致,而且密封性能非常好,可以长时间保存茶叶、酒等而不至变质。小燕同学今年暑假去马来西亚旅游时带回一些锡制茶叶罐,为了检验这些锡器的真伪,小燕同学进行了如下实验:
⑴在锡器上刮取少量锡,用分析天平称得质量为0.589g;
⑵将0.589g锡全部溶于稀盐酸;
⑶向⑵中所得溶液加入过量的FeCl3溶液;
⑷最后用已知浓度的K2Cr2O7溶液滴定⑶中生成的Fe2+。
问题I:写出第⑵、⑶步中化学反应的离子方程式: 第⑵步 ;第⑶步 ;
问题II:第⑷步中K2Cr2O7物质的量浓度为0.100mol·L-1,用去K2Cr2O7溶液的体积为16.00mL。小燕所购回的锡器是真的吗?(如有需要,可参考本试卷中的有关信息)
23.(10分)2005年全世界石油价格居高不下,其主要原因是随着社会生产的发展\人口增多,对能源的需求量逐年增加,全球石油储量下降。寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法。
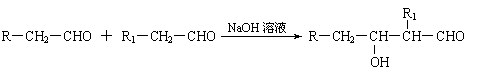 已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
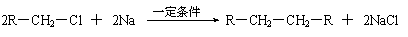 ⑵
⑵
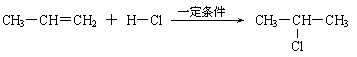 ⑶
⑶
合成路线如下:
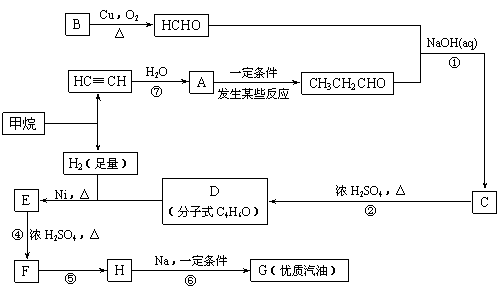
⑴在反应②-⑦中,属于加成反应的是 ,属于消去反应的是 。
⑵写出下列反应方程式
E → F: ;
H → G: 。
⑶H也能与NaOH溶液反应,其反应方程式为 ,
生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化 (选填“能”或“否”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com