
22.(8分)为了测定溶液中Ba2+的浓度,做了以下实验:
① 称取0.1224gK2Cr2O7溶于适量的稀硫酸中,再向其中加入过量的KI溶液与之反应,反应后的溶液加入24.00mLNa2S2O3溶液时恰好反应完全。
② 另取50.00mLBa2+溶液,控制适当的酸度,加入足量K2CrO4的溶液,得BaCrO4沉淀,沉淀经过滤、洗涤后,用适量稀盐酸溶解,使CrO 转化Cr2O
转化Cr2O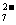 ,再加入过量KI与之反应,反应后再同上述 Na2S2O3溶液反应,反应完全时,消耗Na2S2O3溶液25.00mL,与之有关反应式如下:
,再加入过量KI与之反应,反应后再同上述 Na2S2O3溶液反应,反应完全时,消耗Na2S2O3溶液25.00mL,与之有关反应式如下:
□Cr2O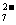 +□I-+□H+--□Cr3++□I2+□H2O □I2+□S2O
+□I-+□H+--□Cr3++□I2+□H2O □I2+□S2O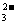 --□S4O
--□S4O +□I-
+□I-
(1)配平上述的离子方程式。
(2)上述两步可用_________________作指示剂,其现象为
(3)试计算溶液中Ba2+的物质的量浓度
21.(11分) 某一反应体系中共有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称叠氧化铅,其中Pb为+2价,N平均为-1/3价)六种物质,已知Pb(N3)2是反应物之一。根据你学过的有关化学定律和知识,回答下列问题:
(1)铅(Pb)的常见化合价是 ,将Pb3O4写成常见化合价的氧化物的形式为 __ (已知Fe3O4可写成FeO·Fe2O3)。
(2)已知Cr的常见化合价为+2、+3、+6,Mn的常见化合价为+2、+4、+6、+7,则Cr(MnO4)2中Cr的化合价为 ,Mn的化合价为 。
(3)Pb(N3)2在该反应中是 剂,它的氧化产物是 ,1mol Pb(N3)2参加反应,转移电子数是 mol。
(4)试写出并配平这个反应的化学方程式。Pb(N3)2+
 。
。
20.(6分)1774年,英国科学家Franklin在皇家学会上宣读论文时提到:“把4.9cm3油脂放到水面上,立即使水面平静下来,并令人吃惊的蔓延开去,使2.0×103m2水面看起来象玻璃那样光滑”。
(1)已知油脂在水面上为单分子层,假设油脂的摩尔质量为M,每个油脂分子的横截面积为Acm2,取该油脂mg,配成体积为VmmL的苯溶液,将该溶液滴加到表面积为Scm2的水中,若每滴溶液的体积为VdmL,当滴入第d滴油脂苯溶液时,油脂的苯溶液恰好在水面上不再扩散,则阿伏加得罗常数NA的表达式为NA= ;
(2)水面上铺一层油(常用十六醇、十八醇,只有单分子厚),在缺水地区的实际意义是
19.(6分) 1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。

(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础 上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
(2)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简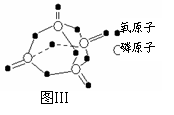 单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/
kJ·mol–1 |
197 |
360 |
499 |
X |
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结如图Ⅲ所示,则上表中X= 。
18.(8分) pH<7的溶液中含有三种常见金属阳离子,用x溶液进行如下实验:

(1)根据有白色沉淀甲生成,判断x溶液中有 阳离子。
(2)根据有白色沉淀丙生成,判断x溶液中有 阳离子;由溶液z生成沉淀丙的离子方程式为 。
(3)x溶液中一定含有的阴离子是 。
(4)根据上述实验 (填“能”或“不能”)确定x溶液中的第3种金属阳离子,理由是 。
17.(13分) 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
① 甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含____________(填化学式,下同)所致。
② 乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_____________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液;b.CCl4; c.无水酒精;d. KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为______________________________。
(5)实验后的思考
① 根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是_______(填离子的化学式)。
② 在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量的浓度为_______________。
16. 某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据:
|
硫酸铜溶液 |
① |
② |
③ |
④ |
|
加入的无水硫酸铜(g) |
2.50 |
5.00 |
8.00 |
11.0 |
|
析出的硫酸铜晶体(g) |
0.10 |
4.60 |
10.0 |
15.4 |
当加入5.60 g 无水硫酸铜时,析出硫酸铜晶体的质量为
A.3.88 g B.5.32g C.5.68 g D.6.82 g
第Ⅱ卷(非选择题 共52分)
15.
某温度下,VmL不饱和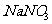 溶液a g,蒸发掉b g水或加入b g
溶液a g,蒸发掉b g水或加入b g 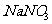 固体(恢复到原温度)均可使溶液达到饱和,则下列量的计算结果正确的是( )
固体(恢复到原温度)均可使溶液达到饱和,则下列量的计算结果正确的是( )
A.
该温度下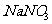 的溶解度为100g
的溶解度为100g
B.
原不饱和溶液中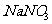 质量分数为
质量分数为
C.
原不饱和溶液中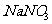 物质的量浓度为
物质的量浓度为
D.
原不饱和溶液的密度为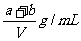
14. 下列反应的离子方程式正确的是 ( )
A.铜片插入氯化铁溶液中 Cu+Fe3+=Cu2++Fe2+
B.电解饱和食盐水 2Cl-+2H+ H2↑+C12↑
H2↑+C12↑
C.向溴化亚铁溶液中通入过量的氯气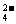 2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液 NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
13. 已知在酸性条件下有以下反应关系:①KBrO3能将I-氧化成KIO3,本身被还原为Br2;
②Br2能将I-氧化为I2;③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,本身被还原为I2。向KBrO3溶液中滴加少量KI的硫酸溶液后,所得产物除水外还有( )
A.Br-、I2 B.Br2、Br-、I2 C.Br2、I2、IO3- D.Br2、IO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com