
5.下列叙述正确的是
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
4. 下列关于晶体的说法一定正确的是
下列关于晶体的说法一定正确的是
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
3.NaF、NaI、MgO均为离子化合物,根据下列数据,判定这三种化合物的熔点高低顺序是
化学式: ① NaF ② NaI ③ MgO
离子电荷数: 1 1 2
键长(10-10m): 2.31 3.18 2.10
A.①>②>③ B.③>①>② C.②>①>③ D.③>②>①
2.下列物质有固定的熔点,且熔点逐渐降低的一组物质是
A.HI、HBr、HCl、HF B.石英、食盐、干冰、钾
C.重油、柴油、煤油、汽油 D. KI、I2、Hg、O2
1.在常温常压下呈气态的化合物,降温使其固化得到的晶体属于
A.分子晶体 B.原子晶体 C.离子晶体 D.何种晶体无法判断
31.(6分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:
(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。
(b)反应①②是化工生产中的重要反应。
(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。
(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。
(e)化合物J由两种元素组成,其相对分子质量为32。

请按要求填空:
⑴反应③的化学方程式 。
⑵H的化学式 。
⑶L的溶液与化合物E反应的离子方程式 。
⑷化合物J的化学式 。
30.(12分)已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
I.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物丁+H2O
氧化物丁+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是__________________。
②若甲为某短周期金属元素的氯化物,且氧化物丁既能与强酸又能与强碱溶液反应,则该金属的原子结构示意图 ____________________________________。
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为 。
II.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙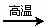 丙。则:
丙。则:
①甲的结构式为 。
②写出上述反应的化学方程式 。
③向NaOH溶液中通入气体甲,由于气体甲通入量不同,所得到的溶液中溶质的组成也不同,试推断其反应后的溶液中溶质有可能的组成,请分别列出
。
4写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式 。
29. (9分)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式: 。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
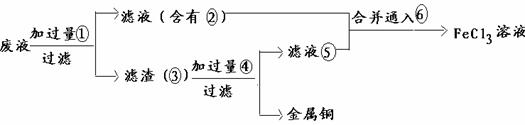
(4)请写出上述实验中3的化学式:
(5)配制硫酸亚铁溶液时,常在其中加入
(6)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为 。
1加入足量氯水2加入足量NaOH溶液3加入少量KSCN溶液
A、13 B、32 C、31 D、123
(7)写出向25的混合液中通入6的离子方程式 。
28. (9分)下表是元素周期表中短周期元素部分,表中字母分别代表一种元素:
|
a |
|
b |
|||||
|
|
|
|
d |
e |
f |
|
|
|
c |
|
|
g |
|
|
h |
|
(1)上述 元素(填字母代号)可以形成硬度最大的单质。
(2)“神舟”六号飞船内需要有一种化合物来吸收宇航员呼出的 CO2,你认为该物质应该是由上表中的 和 元素(填字母代号)组成的,写出该化合物与CO2反应的化学方程式并用双线桥法表示电子转移情况 。飞船中需要制造一种适合宇航员生存的人工生态环境,应该在氧气中充入一种气体用于稀释氧气,该气体分子的结构式是 。
 (3)表中元素g的氢化物热稳定性比元素e的氢化物的热稳定性
(填“强”或“弱”)。
(3)表中元素g的氢化物热稳定性比元素e的氢化物的热稳定性
(填“强”或“弱”)。
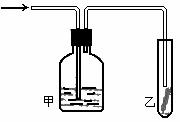
(4)将潮湿的由h元素构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是
①浓硫酸 ②NaOH溶液 ③KI溶液 ④饱和食盐水
27. (3分) 现有下图所示装置,正放在桌面上,可分别实现下列实验目标,其中适用于从Y口进入的是(填字母)
(3分) 现有下图所示装置,正放在桌面上,可分别实现下列实验目标,其中适用于从Y口进入的是(填字母)
A.瓶内盛一定量液体干燥剂,用于干燥气体
B.瓶内盛一定量液体试剂,用于除去气体的杂质
C.瓶内盛一定量水,用于制得可溶于水的气体的饱和溶液
D.瓶内盛满水,用于测量难溶性气体的体积
E.一般用于向上排气法收集某些气体
F.一般用于向下排气法收集某些气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com