
15.某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3∶1。用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是
A.阴极自始自终只析出H2 B.溶液pH不断增大,最后为7
C.电解最后阶段为电解水 D.阳极先析出C12,后析出O2
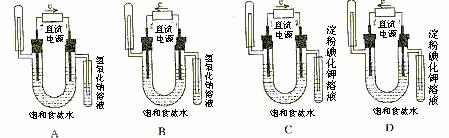
14.下图中验证氯化钠溶液(含酚酞)电解产物的装置是
13.炽热的炉膛内有反应:C(s)+O2(g)==CO2(g);△H = -393.5KJ/mol,往炉膛内通入水蒸气时,有如下反应:C(s) +H2O(g)==H2(g)+CO(g);△H = +131KJ/mol,CO(g)+1/2O2(g)==CO2(g);△H = -283KJ/mol,H2(g)+1/2O2(g)==H2O(g);△H =-241.8KJ/mol,由以上反应推断往炽热的的炉膛内通入水蒸气时
A.不能节省燃料,但能使炉火瞬间更旺B.虽不能使炉火瞬间更旺,但可以节省燃料
C.既能使炉火瞬间更旺,又能节省燃料D.既不能使炉火瞬间更旺,又不能节省燃料
12.25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+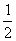 O2(g) = CO(g);△H = -393.5 kJ/mol
O2(g) = CO(g);△H = -393.5 kJ/mol
B.2H2(g) + O2(g) = 2H2O(g);△H = +571.6 kJ/mol
C.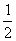 C6H12O6(s) + 3O2(g)
= 3CO2(g) + 3H2O(l);△H = -1 400 kJ/mol
C6H12O6(s) + 3O2(g)
= 3CO2(g) + 3H2O(l);△H = -1 400 kJ/mol
D.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g);△H = -890.3 kJ/mol
11.一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+) == 1×10-13 mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
10.下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O  Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3- +H+ === CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2 Cl-  Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu === Fe2++Cu2+
9.已知I-、Fe2+、SO2、Cl-和H2O2均具有还原性,它们在酸性溶液中还原性强弱顺序是:
Cl- < Fe2+ < H2O2 < I- < SO2,则下列反应中不能发生的是
A.2Fe3+ + SO2 + 2H2O == 2Fe2+ + SO42- + 4H+ B.SO2 + H2O2 == H2SO4
C.2 Fe2+ + I2 == 2 Fe3+ + 2I- D.2 Fe2+ + Cl2 == 2 Fe3+ + 2Cl
8.在一定条件下,RO3n-与R2-发生如下反应:RO3n- + 2R2- + 6H+ == 3R + 3H2O,下列关于元素R的叙述中正确的是
A.R原子的最外层上有4个电子 B.RO3n-中的R只能被还原
C.HnRO3一定是强酸 D.R的单质既有氧化性又有还原性
7.已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2 → H2O、
IO3- → I2、MnO4- → Mn2+、HNO3 → NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.H2O2 B.IO3- C.MnO4- D.HNO3
6.下列叙述正确的是
A.直径介于1nm-10nm之间的微粒称为胶体 B.胶体粒子很小,可以透过半透膜
C.利用丁达尔效应可以区别溶液与胶体 D.电泳现象可证明胶体属于电解质溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com