
25.(6分)如图所示,若电解5min时铜电极质量增加2.16g,试回答:
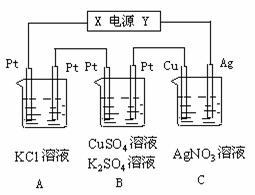
(1)电源电极X名称为 ▲ ;
(2)pH变化:A ▲ 、B ▲ 、C ▲ ;
(3)通过5min时,B中共收集224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为 ▲ 。
24.(6分)有四种同族(系列)的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示:
|
1 |
He -268.8 |
Ne -249.5 |
Ar (x) |
Kr -151.7 |
|
2 |
F2 -187.0 |
Cl2 -33.6 |
(a) 58.7 |
I2 184.0 |
|
3 |
HF (y) |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
4 |
H2O (z) |
H2S -60.2 |
(b) -42.0 |
H2Te -1.8 |
试根据上表回答下列问题:
(1)写出系列2中物质主要化学性质的递变规律(任写1种) ▲ ,能够说明该递变规律的化学事实是 ▲ (任举1例,用离子方程式表示);
(2)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是 ▲ ;
(3)上表中, ▲ 和 ▲ 两种物质的沸点较同系列其它物质反常,反常的主要原因是 ▲ 。
23.(4分)1840年盖斯根据一系列实验事实得出规律,他指出:若是一个反应可以分几步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。已知热化学方程式:
C(S,金刚石) + O2(g) = CO2(g);△H = -395.41KJ/mol
C(S,石墨) + O2(g)= CO2(g);△H = -393.51KJ/mol
则金刚石转化为石墨的热化学方程式为 ▲ ,由热化学方程式看来更稳定的碳的同素异形体是 ▲ 。
22.(6分)在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变为蓝色,其反应的离子方程式为 ▲ 。在上述蓝色溶液中滴入足量的Na2SO3溶液,蓝色立即消失,其反应的离子方程式为 ▲ ,从以上实验可知,ClO-、I2、SO42-的氧化性由强到弱的顺序是 ▲ 。
21.(8分)2gCu2S 和CuS 的混合物在酸性溶液中用400mL0.075mol /L KMnO 4溶液处理,发生反应如下:8MnO 4-+5 Cu2S+44H+=10Cu 2++5SO 2+8Mn 2++22H2O;
6MnO 4-+5 CuS+28H+=5 Cu 2++5SO 2+6Mn 2++14H2O。反应后煮沸溶液,赶尽SO2,剩余的KMnO 4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO 4-+ Fe2+ + H+= Mn2++ Fe3++ H2O;
(2)KMnO 4溶液与混合物反应后,剩余KMnO 4的物质的量为 ▲ mol;
(3)欲配制500mL0.1 mol /L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 ▲ g;
(4)混合物中Cu2S的质量分数为 ▲ 。
20. 城市环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源,d处在下游有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的是
城市环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源,d处在下游有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的是
A.造成X河污染的主要污染源最可能分布在bc段
B.工业废水、生活污水、固体废弃物等可能是造成X河污染的污染源
C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致
D.该城市建造硫酸厂时,综合考虑诸多因素选址在b处最合理。
第Ⅱ卷(非选择题,共60分)
19.有关接触法制硫酸的叙述中,不正确的是
A.用硫铁矿代替硫,可减少环境污染
B.SO2进接触室前要净化,以免催化剂中毒
C.热交换的目的,一方面使即将参加反应的气体达到一定温度,另一方面降低SO3的温度
D.尾气经过处理后才能排放到空中
18.右图为接触室的示意图,从A处出来的气体为
A.SO2 B.SO3、O2 C.SO2、O2 D.SO2、SO3、O2
17.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放
 电电压。高铁电池的总反应为:
电电压。高铁电池的总反应为:
下列叙述不正确的是
A.放电时负极反应为:Zn-2e- +2OH- = Zn(OH)2
 B.充电时阳极反应为:Fe(OH)3 -3e- + 5OH- = FeO42- + 4H2O
B.充电时阳极反应为:Fe(OH)3 -3e- + 5OH- = FeO42- + 4H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
16.下列描述中,不符合生产实际的是
A.电解熔融的氧化铝制取金属铝,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在镀件上电镀锌,用锌作阳极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com