
21.(3分)下列实验中所选用的仪器或操作以及结论不合理的是
A.用托盘天平称量11.7g氯化钠晶体
B.用碱式滴定管量取25.00mL溴水
C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
E. 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
F. 向某溶液中先通Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
20.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是 ( )
A.硫酸铜溶液的PH B.溶液中溶质的质量分数
C.硫酸铜的溶解度 D.溶液中Cu2+的数目
第Ⅱ卷(非选择题共60分)
二实验题(共21分)
19.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是: ( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打;
B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显现象的是小苏打;
C.用两只玻璃杯分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小苏打 ;
D.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打;
18.某结晶水合物化学式为R·nH2O,其式量为M。 25℃时,将a g该晶体溶于b g H2O中恰好形成V ml饱和溶液。下列表示式正确的是( )
A.25℃时R的溶解度为: g
g
B.饱和溶液溶质的质量分数为: %
%
C.饱和溶液物质的量浓度为: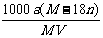 mol·L-1
mol·L-1
D.饱和溶液的密度为: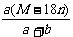 g·mL-1
g·mL-1
17.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
|
|
① |
② |
③ |
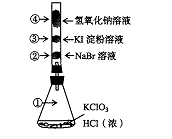 ④ ④ |
|
A |
黄绿色 |
橙色 |
蓝色 |
白色 |
|
B |
无色 |
橙色 |
紫色 |
白色 |
|
C |
黄绿色 |
橙色 |
蓝色 |
无色 |
|
D |
黄绿色 |
无色 |
紫色 |
白色 |
16.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
15.实验室制备硝酸铝[Al(NO3)3·9H2O]可使用下列方法:
 。
。
反映上述有关反应的离子方程式错误的是( )
A.2Al+2OH-+2H2O=2AlO2-+3H2↑ B.2HCO3-+2AlO2-+H2O=2CO2↑+2Al(OH)3↓
C.NH4++AlO2-+2H2O=NH3·H2O+ Al(OH)3↓ D.3H++Al(OH)3===Al3++3H2O
14.相同溶质的两份溶液,一份质量分数为ω1,密度为ρ1g·cm-3,浓度为amol·L-1,另一份质量分数为ω2,密度为 ρ2g·cm-3,浓度为bmol·L-1,若2a=b,
ω2<2ω1,则ρ1与ρ2的大小关系是( )
A.ρ1=ρ2 B.ρ1>ρ2 C.ρ1<ρ2 D.无法比较
13.下列离子方程式正确的是
A、在碳酸氢钙溶液中加入过量的氢氧化钠溶液
Ca2++2HCO3-+2OH- === CaCO3↓+2H20+CO32-
B、在溴化亚铁溶液中通入过量的Cl2气
Fe +2Br
+2Br +2Cl2===Fe
+2Cl2===Fe +Br2+4Cl
+Br2+4Cl
C、在硫酸溶液中加入氢氧化钡溶液至溶液恰好呈中性
H+ +SO42-+OH-+Ba2+===BaSO4↓+H2O
D、在次氯酸钙溶液中通入二氧化硫至过量
Ca2+ +2ClO-+H2O + SO2==CaSO3↓+2HClO
12.右图中a、b、c、d、e为周期表前4周期的一部分,下列叙述正确的是
 A.b元素除0价外,只有一种化合价
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素形成的单质性质最稳定
C.c、d元素最高价氧化物的水化物酸性:c > d
D.e元素在自然界中主要存在于海水中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com