
25(12分)环保检测部门测定某气体样品中含一氧化碳的含量,其方法和实验步骤如下:
① 将2.000L的气体样品通过盛有I2O5固体的加热管,发生的反应为:5CO + I2O5  5CO2
+ I2。
5CO2
+ I2。
② 将所产生的碘升华,并加入30.00mL 0.0050 mol·L-1的硫代硫酸钠溶液,发生的反应为:
I2 + 2S2O32- = 2I-+ S4O62-
③ 将②中溶液取出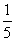 ,加入1.000mL 0.0100 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
,加入1.000mL 0.0100 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
试计算1L该气体样品中有多少毫克(mg)的CO?
23.(8分)在化学上常用两种模型来表示分子结构,一种是球棍模型,另一种是比例模型。比例模型是用不同颜色球的体积比来表示分子中各种原子的体积。
(1)右图是一种常见有机物的比例模型,该模型图可代表一种( )
 A.饱和一元醇 B.饱和一元醛
A.饱和一元醇 B.饱和一元醛
C.二元酸 D.羟基酸
(2)该物质可发生的反应有( )
A.与H2加成 B.银镜反应
C.消去反应 D.与乙醇酯化
(3)根据(2)中选择,写出该物质发生反应的化学方程式。
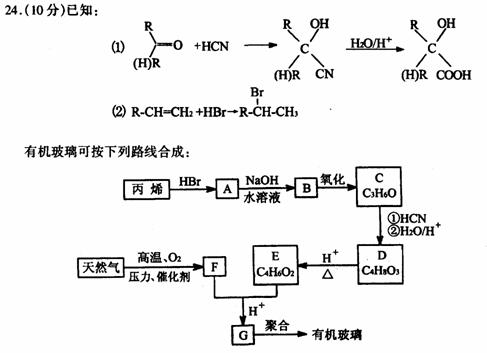
有机玻璃可按下列路线合成:F亦可由水煤气在高温、高压、催化剂存在下合成。试写出:
(1)天然气的主要成分和C的结构简式分别为 、
(2)E+F→G的反应方程式为
(3)丙烯→A和A→B的反应类型分别属于 、
(4)G→有机玻璃的反应方程式为
22.(10分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
(1)写出两种均含A、B、C、D四种元素的化合物相互间发生反应。且生成气体的离子方程式 。(2)写出CD两元素形成的化合物的电子式 。
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止气体透过的隔膜。在一极通入A的单质,另一极通入B的单质,写出该电池发生的电极反应式:通入A单质的一极 通入B单质的一极 。
(4)D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液呈均碱性,写出该氧化还原反应的离子方程式
21.(12分)工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
2FeSO4  Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
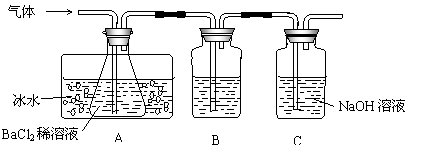 (SO2沸点为-10.02℃)
(SO2沸点为-10.02℃)
请回答相关问题:
(1)A瓶所盛试剂的作用是 ;B瓶所盛的试剂是 ;C瓶所盛试剂的作用是 。
(2)A瓶要用冷水冷却的原因是 。
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则 。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
理由是 。
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤) 。
20. (12分)在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
(12分)在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
(1)碘位于元素周期表中的第 族,第 周期。
(2)步骤①加Fe的目的是 。
(3)写出步骤②的化学方程式 。
(4)上述生产流程中,可以利用的副产物是 ,考虑原料循环利用,若将该副产物制成生产所需的试剂,先后还需加入 来进行处理。
(5)甲物质见光易变黑,其原因是(用化学方程式表示): 。
(6)分离I2和丁的方法是 。
19.(14分)(1)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体):
②容量瓶:
③滴定管:
④集气瓶(收集氨气):
⑤托盘天平
(2)下面是某研究性学习小组对蜡烛及其燃烧的研究报告,请你完成该实验报告:(4分)
|
探究步骤 |
实验现象 |
结论或产生这一现象的原因 |
|
①将一小块蜡烛放入水中 |
|
结论:
|
|
②燃着时 |
有明亮火焰 |
|
|
③刚吹灭时 |
|
原因: |
18.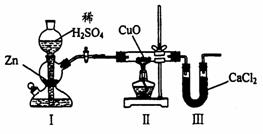 用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
A.I、Ⅱ装置之间缺少干燥装置
B.CuO没有全部被还原
C.Ⅱ装置中玻璃管内有水冷凝
D.Ⅲ装置后缺少干燥装置
第Ⅱ卷(非选择题共78分)
17.下列混合液中,各离子浓度的大小顺序正确的是
A.10ml.1mol/LNIH4Cl溶液与5mL0.2mol/LNaOH溶液混合,
c(Na+)>c(C1-)>c(OH-)>c(H+)
B.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2moL/LNaOH溶液混合,
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mLlmoL/L盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
16.下列叙述中,正确的是
A. 分子晶体的状态变化,只需克服分子间作用力
B. 离子晶体中一定含有金属阳离子
C. 金属晶体容易导电,是因为其中含有自由电子
D. 原子晶体中只存在非极性共价键
15.燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化成电能的装置,电解质是强碱溶液。下面关于甲烷燃料电池的说法正确的是
A.负极反应为O2+2H2O+4e==4OH--
B.负极反应为CH4+10OH--8e==CO32-+7H2O
C.放电时溶液中的阴离子向负极移动;
D.随放电的进行,溶液的pH不变。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com