
15.下列各组离子,在指定的环境中能大量共存的是
A.在酸性溶液中:K+、Cl- 、NO3-、I-、Fe2+
B.pH=7的溶液中:Al3+、Cl-、SO42-、HCO3- 、S2-
C.能溶解铝片并放出氢气的溶液中:Na+、Mg2+、Cl-、NO3-、SO42-
D.使PH=12的溶液中:Na+、AlO2-、NO3-、S2-、SO32-
14.下列反应的离子方程式书写正确的是
A.硫酸铜溶液中通入过量的硫化氢:Cu2++S2-=CuS↓
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O
C.过量的SO2气体通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3-
D.硫化钠溶于水中:S2- + 2 H2O = H2S↑ + 2 OH-
13.下列说法或表示方法正确的是
A. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B. 由C(石墨)→C(金刚石); △H= +1.91 kJ/mol,可知金刚石比石墨稳定
C. 在稀溶液中:H+(aq)+OH-(aq)==H2O(1);△H= -57.3 kJ/mol,若将含1molCH3COOH的醋酸与含l mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
D. 在101 kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)==2H2O(1); △H= -285.8 kJ/mol
12.同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是
A.2Na218O2+2H2O=4Nal8OH+O2↑
B.2KMnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2O
C.NH4Cl+2H2O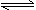 NH3·2H2O+HCl
NH3·2H2O+HCl
D.K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
11.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.Na2O2+2H2O=4NaOH+O2 B.CaC2+H2O→Ca(OH)2+CH≡CH↑
C.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ D.NH4Cl+NaOH NaCl+H2O+NH3↑
NaCl+H2O+NH3↑
10.已知把SO2气体通入BaCl2溶液中无沉淀生成,现把下列物质加入或通入溶液中,能出现沉淀的是
⑴N2 ⑵NO2 ⑶Cl2 ⑷H2O2 ⑸H2S ⑹NH3 ⑺SO3 ⑻KMnO4 ⑼HCl ⑽Na2O2 ⑾CO2 ⑿AgNO3
A.只有⑴⑵⑶⑸⑺⑼ B.只有⑵⑶⑷⑸⑹⑺⑻⑽⑿
C.只有⑵⑸⑺⑼⑽⑾ D.只有⑵⑶⑸⑺⑼⑾
9. 第三周期元素x,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
A.x元素最高价氧化物对应的水化物一定是强酸
B.x的单质在固态时一定属于原子晶体
C.x元素在常温下稳定存在的氧化物一定能与烧碱反应
D.x的单质一定是良好的半导体材料
8.下列说法中正确的是(NA表示阿伏加德罗常数的值)
A.SiO2晶体中,1 mol硅原子与氧原子形成的共价键数是2NA
B.标准状况下,1 L己烷所含碳原子个数约为6NA/22.4
C.3.2 g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA
D.常温常压下,0.1 mol氖气含有的电子数为NA
7.下表是X、Y、Z三种元素的氢化物的某些性质
|
元素 |
熔点/℃ |
沸点/℃ |
与水反应 |
导电性(纯液体) |
|
X |
-183 |
-162 |
不反应 |
不导电 |
|
Y |
-102 |
19 |
放热反应,形成酸性溶液 |
不导电 |
|
Z |
680 |
- |
剧烈反应,生成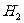 ,并形成碱性溶液 ,并形成碱性溶液 |
导电 |
若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是
A.X、Y、Z B.Z、X、Y C.Y、X、Z D.Z、Y、X
6.下列对化学知识概括合理的是
A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B.氧化物不可能是还原产物,只可能是氧化产物
C.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
D.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com