
25.(9分)我国目前使用的燃料主要是煤和石油,含有硫的煤燃烧时生成的SO2会污染空气:
(1)某火力发电厂每天燃烧含硫2%的煤100t,若煤中的硫有90%转化为SO2,则该厂每天产生SO2 t;若用熟石灰吸收煤燃烧时生成的SO2气体,并转化为石膏(CaSO4•2H2O),假设SO2气体全部转化为石膏,则该厂每天产生石膏 t。
(2)国家标准规定工业废气中SO2含量不得超过0.15mg/m3,工业上测量SO2含量时,可以根据反应:SO2+2H2O+I2=H2SO4+2HI,现取该厂的废气样品1000L,用0.0254%的碘溶液2g恰好完全反应,计算该厂排放的废气中SO2的含量是否符合国家标准。
24.(3分) 硼有两种天然同位素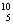 B和
B和 B,硼元素的近似相对原子质量为10.80,则对硼元素
B,硼元素的近似相对原子质量为10.80,则对硼元素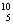 B
B
质量分数 (填=20% 或略大于20%或略小于20%)
23.(10分)某校化学小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO。(图中夹持装置及尾气处理装置均已略去)
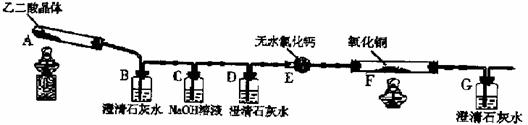
(1)装置C中盛放NaOH溶液的作用是 。
(2) ①证明分解产物中有CO2的现象是 ②证明分解产物中有CO的现象是 。
(3)实验结束后,装置F中黑色氧化铜变为红色固体。简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O)溶于稀硫酸生成铜单质和硫酸铜):
|
|
滴定前 |
第一次终点 |
第二次终点 |
第三次终点 |
|
滴定管 液面刻度 |
0.00mL |
16.02mL |
16.00mL |
16.01mL |
(4)实验室常用草酸钠标定KMnO4溶液。操作如下:准确称取0.2000g草酸钠(Na2C2O4),放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定。当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点。重复上述滴定操作三次,实验数据如下表所示。
KMnO4溶液的物质的量浓度的计算式是c(KMnO4)= 。(不要求计算结果)
22.(4分)下列有关实验的叙述,正确的是(填序号)
A.渗析法分离KI和淀粉 B.用浓溴水分离苯和苯酚
C.盐析法分离硬脂酸钠和甘油 D.用饱和NaHCO3溶液洗气除去CO2中少量的SO2气体
E.某无色溶液加过量盐酸无沉淀,再加Ba(NO3)2产生白色沉淀,则溶液中一定含SO42-
F.用浓氨水洗涤做过银镜反应的试管 G.用托盘天平称取10.50g干燥的NaCl固体
H.用胶头滴管向试管中滴加液体,滴管一定不能伸入到试管中
I.用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物
J.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
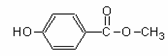
21.(6分)尼泊金甲酯可在化妆品中作防腐剂,其结构简式为
(1) 写出尼泊金甲酯在氢氧化钠溶液中加热时反应的化学方程式 。
 (2)
香兰素是尼泊金甲酯的同分异构体,其结构简式为
(2)
香兰素是尼泊金甲酯的同分异构体,其结构简式为
① 香兰素可发生的反应是(填字母)_____________。
a. 加成反应 b. 水解反应 c. 和浓溴水的取代反应 d. 消去反应
② 检验香兰素中官能团的方法很多,请任意列举(一种官能团及其检验方法)
所检验的官能团名称为____________,检验方法是___________________ 。
20.(8分)在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出)
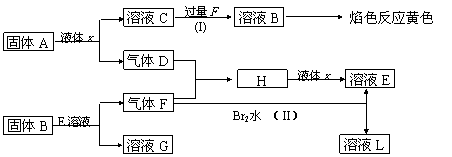
请回答:
(1)固体A是(写化学式)
(2)反应D+F →H 的条件是
(3)反应(I)的化学方程式
(4)反应(II)的离子方程式
19.( 8分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
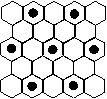
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许
多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜
色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质
的化学式为 。
18.(6分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
 (1)比较下列两组物质的熔点高低(填“>”、“<”或“=”)
(1)比较下列两组物质的熔点高低(填“>”、“<”或“=”)
SiC Si;SiCl4 SiO2
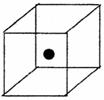
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子
(硅晶体的结构与金刚石相似)。
|
SiCl4(g)+2H2(g)
Si(s)+4HCl(g)该反应的反应热△H=
kJ/mol
17.(6分)已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液
为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1) KMnO4、H2O2、PbO2氧化性由强到弱的顺序为_________ _______
(2) 实验④中的现象为:____ ___________
(3 )实验③反应的离子方程式分别是:_______________________
16.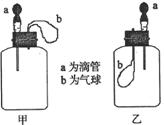 如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(含另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球及外界和广口瓶间热量的传递的影响)。则所用试剂不可能是
如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(含另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球及外界和广口瓶间热量的传递的影响)。则所用试剂不可能是
A.甲:H2O和CaO(固体); 乙:H2O和NH4NO3(固体)
B.甲:盐酸和Na2O2(固体); 乙:亚硫酸钠溶液和氯气
C.甲:NaOH溶液和CO2; 乙:盐酸和NaHCO3溶液
D.甲:浓H2SO4和蔗糖(固体);乙:H2O和NO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com