
10.将质量分数为0.052(5.2%)的NaOH溶液1升(密度为1.06克/毫升)用铂电极电解,当溶液中的NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是
|
|
NaOH的质量分数 |
阳极析出物的质量(克) |
阴极析出物的质量(克) |
|
A |
0.062(6.2%) |
19 |
152 |
|
B |
0.062(6.2%) |
152 |
19 |
|
C |
0.042(4.2%) |
1.2 |
9.4 |
|
D |
0.042(4.2%) |
9.4 |
1.2 |
9.
某温度下,在一容积可变的容器中,反应2A(g)+B(g)  2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半 B.均加倍
C.均增加1 mol D.均减少1 mol
8.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):
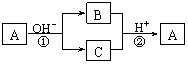
下列判断正确的是( )
A.X元素可能为Al B.X元素一定为非金属元素
C.反应①和②互为可逆反应 D.反应①、②不一定为氧化还原反应
7.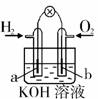 燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如右图所示,a、b均为惰性电极。下列叙述不正确的是
燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如右图所示,a、b均为惰性电极。下列叙述不正确的是
A.a极是负极,该电极上发生氧化反应
B.b极反应是O +4OH
+4OH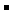 -4e
-4e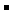 =2H
=2H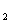 O
O
C.总反应方程式为2H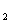 +O
+O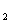 =2H
=2H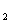 O
O
D.氢氧燃料电池是一种具有应用前景的绿色电源
6.下列关于晶体的说法一定正确的是
 A.第ⅠA碱金属元素与ⅦA元素所形成的化合物在固态时为离子晶体,晶体中阴、阳离子排列方式相同
A.第ⅠA碱金属元素与ⅦA元素所形成的化合物在固态时为离子晶体,晶体中阴、阳离子排列方式相同
B.晶体中存在阴离子就必定存在阳离子,存在阳离子就必定存在阴离子
C.离子晶体中只含有离子键,分子晶体、原子晶体中必定含有共价键
D.C60晶体(其结构模型如上图)中每个C60分子周围与它距离最近且等距离的C60分子有12个
5.X、Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是 ( )
A.X的金属性比Y的金属性强
B.常温下,X和Y都不能从水中置换出氢
C.Y元素的最高价氢氧化物碱性比X元素最高价氢氧化物碱性强
D.Y元素的最高化合价比X元素的最高化合价高
4. 100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) 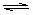 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①烧瓶内气体的颜色不再加深,②N2O4 的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体的平均相对分子质量不再变化
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
3.分析下图所示的四个原电池装置,其中结论正确的是
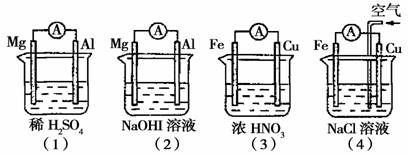
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为:6H2O+6e-→6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为:Fe→Fe2++2e-
D.(4)中Cu作正极,电极反应式为:2H++2e-→H2↑
2.我国神舟六号飞船发射时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ•mol-1。关于肼和二氧化氮反应的热化学方程式中正确的是
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7kJ•mol-1
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1
C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g)△H=-1135.7kJ•mol-1
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=+1135.7kJ•mol-1
1.查阅资料发现,金属钠不仅能跟氧气和水反应.还能跟多种其它物质发生反应,其中包括与酒精在常温下反应。要研究金属钠跟酒精反应的性质以及它与水反应的异同点, 下列的研究方法中没有用到的是
A.实验法 B.观察法 C.分类法 D.比较法
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com