
20.(6分).在室温下,将表面积相同、纯度相同、体积也相同的同种锌片分别投入等体积0.1mol/L的稀硫酸和0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异,投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸的快,运用你所学过的知识分析产生这一现象的原因可能是什么,并设计实验来证明你的推论是正确的。
19.(12分)实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH 溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是_______(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:_________________________________________________________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
18.(10分).下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径 (10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素形成的单质中,与水反应最剧烈的金属是 (填写编号)。
 (2)上述⑤、⑥、⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为 、
。
(2)上述⑤、⑥、⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为 、
。
(3)某元素R的原子半径为1.02×10-10m,该元素是 ;化合物Na2R2的电子式为_____________________。
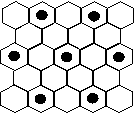
(4)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
17.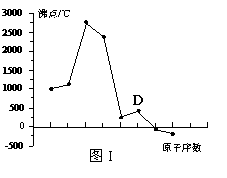 (8分) 原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
(8分) 原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
|
化合物 |
甲 |
乙 |
丙 |
|
原子个数比 |
B∶A=1∶3 |
C∶A=1∶2 |
D∶A=1∶2 |
⑴元素D在元素周期中的位置 。
⑵B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到稳定结构,则X的化学式为 ;X的熔点 金刚石(填“大于”、“等于”或“小于”)。
⑶写出图I中沸点最高的单质与NaOH溶液反应的离子式 。
16.已知五种短周期元素的原子半径及主要化合价(最高正价、最低负价)如下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.T的原子叙述最小
B.相同条件下,L、M的单质分别与稀盐酸反应速率:M>L
C.T、Q的氢化物常温常压下均为无色气体
D.M的最高价氧化物可用作耐火材料
15.500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
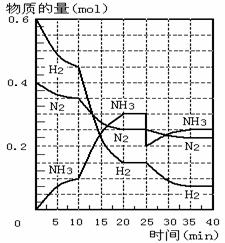 A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至
20min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min钟 时,分离出0.1mol的氨气
D.在25min钟时平衡正向移动但达到新平衡后
NH3的体积分数比原平衡小
14、在一定条件下化学反应:2SO2(g) + O2(g)
 2SO3(g);△H=-197kJ·mol-1。现有容器固定且相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和该反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197kJ·mol-1。现有容器固定且相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和该反应放出的热量(Q)如下表所列:
|
容器 |
SO2(mol) |
O2(mol) |
He(mol) |
Q
(kJ) |
|
甲 |
2 |
1 |
0 |
Q
1 |
|
乙 |
1 |
0.5 |
0 |
Q
2 |
|
丙 |
1 |
0.5 |
1 |
Q
3 |
根据以上数据,下列叙述不正确的是
A、 Q1<197 B、Q2 = Q3 C、Q1 = 2Q2 D、Q1 >2Q2
13.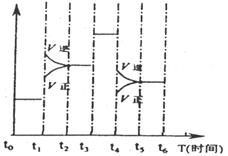 右图表示反应N2(g)+3H2(g) ⇌2NH3(g);△H<0在某一时间段中反应速率与反应过程的曲线关系图,则氨的百分含量最低的一段时间是.
右图表示反应N2(g)+3H2(g) ⇌2NH3(g);△H<0在某一时间段中反应速率与反应过程的曲线关系图,则氨的百分含量最低的一段时间是.
A. to-t1 B. t2-t3
C. t3-t4 D. t5-t6
12. 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为
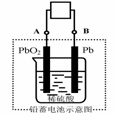 Pb+PbO2+4H++2SO42-
2PbSO4+2H2O,
Pb+PbO2+4H++2SO42-
2PbSO4+2H2O,
则下列说法正确的是
A.放电时:电流方向由B到A
B.放电时:正极反应是Pb-2e-+SO42- PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H+
PbO2+SO42-+4H+
11.下列叙述不正确的是
A.原子晶体中原子间平均距离越小,熔、沸点越高
B.在水溶液中能电离出自由移动的离子的晶体不一定是离子晶体
C.SnH4 、GeH4、SiH4、CH4四种物质的熔点依次降低
D.水加热到很高的温度都难以分解,是因为水分子之间存在着氢键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com