
9、下列物质中不能通过化合反应得到的有多少种
①FeCl2 ②SO3 ③CuS ④Fe(OH)3
A、一种 B、二种 C、三种 D、四种
8、一定条件下,可逆反应X(g)+3Y(g)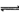 2Z(g),若X、Y、Z起始浓度分别为C1、C2 、C3、(均不为零),平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1,、0.08mol·L-1,则下列判断错误的是
2Z(g),若X、Y、Z起始浓度分别为C1、C2 、C3、(均不为零),平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1,、0.08mol·L-1,则下列判断错误的是
A、X、Y的转化率不相等 B、C1:C2=1:3
C、平衡时,Y和Z的生成速率之比为3:2 D、 C1的取值范围是0<C1<0.14 mol·L-1
7、用pH均为1的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸的溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A、Vl≤V2 B、 Vl<V2 C、Vl==V2 D、Vl>V2
6、下列反应的离子方程式正确的是
A、向氢氧化钡溶液中加入过量硫酸氢铵溶液:
Ba2+十2OH-十NH4+ + H+ + SO42- = BaSO4↓+NH3·H2O + H2O
B、明矾净水的离子方程式:Al3++3H2O
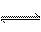 Al(OH)3 + 3H+
Al(OH)3 + 3H+
C、用澄清石灰水吸收过量二氧化碳气体:OH- + CO2 = CO32-
D、向次氯酸钙溶液中通入二氧化硫气体:
Ca2++2ClO- + SO2 + H2O = CaSO3 ↓+ 2HClO
5、用NA表示阿伏加德罗常数的值,下列说法中正确的是
A、6.8 g熔融的KHSO4中含有0.1NA个阳离子
B、如果5.6LN2含有n个氮分子,则NA约为4n
C、在SiO2晶体中,若含有1mol Si原子,则Si-O键数为4NA
D、用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA
4、下列条件下,两瓶气体所含的原子数一定相等的是
A、同压强、同体积的N2O和CO2 B、同温度、同体积的H2和N2
C、同体积、同密度的C2H4和C4H6 D、同质量、不同密度的N2和CO
3、月球上有丰富的 3 2He,每百吨 3 2He聚变所释放出的能量相当于人类一年消耗的能量总和,地球上氦元素主要以4 2He的形式存在。已知一个12C原子的质量为ag,一个3 2He原子的质量为bg,(NA为阿伏加德罗常数的值)下列说法正确的是
A、3 2He比4 2He少一个质子 B、氦元素的近似相对原子质量为3
 C、3 2He的相对原子质量为 12b a D、3 2He的摩尔质量为bNAg
C、3 2He的相对原子质量为 12b a D、3 2He的摩尔质量为bNAg
2、闪电时空气中有臭氧生成,下列说法正确的是
A、O2和O3互为同位素 B、O2比O3稳定
C、等体积的O2和O3具有相同的质子数 D、O2与O3的相互转变是物理变化
1、下列化工生产过程所发生的反应不属于氧化还原反应的是
A、用油脂制肥皂 B、用铝土矿制金属铝
C、用氯气和消石灰制漂白粉 D、用氢气和氮气合成氨
24.(8分)生活中,人们越来越注意微量元素的摄入,碘元素对人体健康与发育有着至关重要的作用。若缺少碘元素,则会造成幼儿痴呆、发育不良,易患地方性甲状腺肿。为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40mg~50mg的碘酸钾。据此回答下列问题:
 (1)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定的电流强度和温度下电解KI溶液。总反应化学方程式为
(1)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定的电流强度和温度下电解KI溶液。总反应化学方程式为
KI+3H2O KIO3+3H2↑。阳极反应式为
。
(2)为检验某食盐中是否含有碘酸钾。某同学取食盐样品428g溶解后,加入盐酸酸化的淀粉碘化钾溶液,溶液呈蓝色。反应的离子方程式为 ,
该反应中氧化产物与还原产物的物质的量之比为 。
(3)为进一步验证该样品是否为合格产品,该生再用0.030mol/L的硫代硫酸钠溶液对上述溶液进行滴定,当用去18.00mL时蓝色刚好又褪去(I2+2S2O32-====S4O62-+2I-),计算得每千克该加碘盐中碘酸钾的含量为 ,该加碘食盐为
(填“合格”或“不合格”)食盐。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com