
14.1183 K以下纯铁晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。
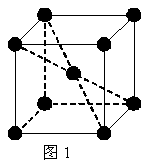

(1)在1183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为_______个;在1183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为___________;
(2)纯铁晶体在晶型转变前后,二者基本结构单元的边长之比为(1183 K以下与1183 K以上之比)___________。
(3)转变温度前后两者的密度比(1183 K以下与1183 K以上之比)____。
13.下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径 (10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是
(填写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的
 电子式
。
电子式
。
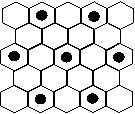
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
12.A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子核外层电子数是次外层电子数的2倍。D元素是地壳里含量最多的元素。D与E的质子数之和为24。F的最高价氧化物的水化物为最强酸。
(1)推断E在元素周期表中的位置:第 周期, 族。
(2)B与D形成的化合物BD2的电子式为: 。
(3)A2D的沸点比A2E高的原因是 。
(4)A、C、F三元素形成的化合物CA4F,溶于水,所得溶液中各种离子物质的量浓度的大小顺序为(按从大到小的顺序排列) 。
(5)在101kPa时,1.4gBD气体在1.6gD2气体中完全燃烧,生成BD2气体时放出14.15kJ热量,表示BD燃烧热的热化学方程式为:
。
11.pH=1的溶液x中含有三种常见金属阳离子,用x溶液进行如下实验:
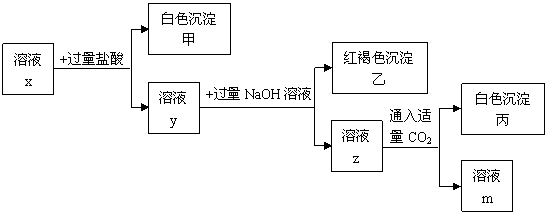
(1)根据有白色沉淀甲生成,可判断x溶液中有 阳离子, 阴离子。
(2)综合分析有红褐色沉淀乙生成, (填“能”或“不能”)确定x溶液中的一种金属阳离子,理由是
。
(3) 根据有白色沉淀丙生成,可判断x溶液中可能有 阳离子。
8.下列关于氧化物的各项叙述正确的是:①酸性氧化物肯定是非金属氧化物 ②非金属氧化物肯定是酸性氧化物 ③碱性氧化物肯定是金属氧化物 ④金属氧化物都是碱性氧化物 ⑤酸性氧化物均可与水反应生成相应的酸 ⑥与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物 ⑦不能跟酸反应的氧化物一定能跟碱反应
A.①②③④ B.⑤⑥⑦
C.②③⑥⑦ D.③⑥
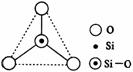 (
)9.如右图所示,某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是
(
)9.如右图所示,某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是
A.键角为120° B.化学组成为SiO32-
C.键角为109°28′ D.化学组成为SiO44-
( )10下列物质中,含极性键和非极性键且分子有极性的是
A.乙烯 B.乙醛
C.甲醇 D.三氯甲烷
7.A、B、C是短周期的三种元素,原子序数依次递增,A与C为同族元素,C与A相互间可形成原子个数比为1:2或1:3的化合物,B与A相互间只能形成一种化合物,则下列说法正确的是
A.原子半径:A>B>C B.B与A形成的化合物熔点高
C.B只能是金属 D.B可能是金属,也可能是非金属
6.X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是
A.② B.②④
C②⑤⑥ D.①②③④
5.最近发现一种由M、N两种原子构成的气态团簇分子,如图所示。 实心球●表示N原子,空心球○表示M原子,它的化学式为
A.M4N4 B.MN
C.M13N14 D.M4N5
4.下列叙述正确的是
A.由多种非金属元素组成的化合物一定是共价化合物
B.含有金属元素的化合物一定是离子化合物
C.晶体熔化时化学键不一定发生断裂
 D.原子晶体的熔点一定比金属晶体高
D.原子晶体的熔点一定比金属晶体高
3.1919年,科学家第一次实现了人类多年的梦想--人工转变元素。这个核反应如下: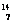 N+
N+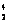 He→
He→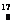 O+
O+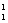 H下列叙述正确的是
H下列叙述正确的是
A.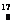 O原子核内有9个质子
O原子核内有9个质子
B.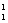 H原子核内有1个中子
H原子核内有1个中子
C.O2和O3互为同位素
D.通常情况下,He和N2化学性质都很稳定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com