
13.A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为l∶1和1∶2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
⑴写出元素符号:B________,D________。
⑵A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
⑶1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式:
⑷B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为_____________________________________。
12.A、B、C、D都是短周期元素。已知常温下,A和B有两种液态化合物,其最简式分别为BA和B2A;B与D既可形成X分子,也可形成Y阳离子,且X、Y都是含有10电子的粒子;C应用于电光源,制得的高压灯发出透雾能力极强的黄光。
(1)Y中的化学键类型为 ,其空间构型为 。
(2)液态X类似B2A,也可能部分电离,产生电子数相同的两种离子,则液态X的电离方程式为
(3)M、N是由A、B、C、D四种元素中的三种组成的不同类型的强电解质,且M、N的水溶液中,水的电离程度前者一定小于后者,则M、N的化学式分别为:M 或 ,N 或 。
11.A、B、C是短周期的三种元素,原子序数依次递增,A与C为同族元素,C与A相互间可形成原子个数比为1:2或1:3的化合物。若B与A相互间只能形成一种化合物,它们可为 ,从物理性质看,它们都可作 材料;若B与A相互间能形成两种离子化合物,它们
的电子式分别为 、
10.( )几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.L、R的单质与稀盐酸反应速率L<R
B.M与T形成的化合物有两性
C.Q、T两元素的氢化物分子间都存在氢键
D.L、Q形成的简单离子核外电子数不等
8.( ) A、B两主族元素属于同一周期,它们可以形成化学式为AB2型分子。则A、B元素分别在周期表中的族序数不可能为
A.ⅣA、ⅥA B.VA、ⅥA
C.ⅡA、ⅦA D.ⅡA、IA
( ) 9.已知CsCl晶体的密度为
9.已知CsCl晶体的密度为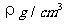 ,NA为阿伏加德罗常数,相邻的两个
,NA为阿伏加德罗常数,相邻的两个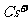 的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为
A. 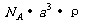 B.
B.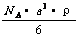
C. 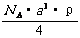 D.
D.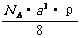
7.( )下列说法错误的是
①原子及其离子的核外电子层数等于该元素所在的周期数
②元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
③除氦外的稀有气体原子的最外层电子数均为8
④同一元素的各种同位素的物理性质、化学性质均相同
A.①④ B.②③ C.②④ D.①②
6.( )我国科学家合成出世界上最细的碳纳米管,直径仅有0.5nm,它的直径与C36分子直径相当,十分接近0.4nm理论极限值,这项成果获取2002年度国家自然科学二等奖。已知C36是由正五边形和正六边形构成的足球状分子,在多面体中,棱边数=顶点数+面数-2。根据以上信息,下列有关推断不正确的是
A.碳纳米管与金刚石互为同素异形体
B.碳纳米管属于高分子化合物
C.每个C36分子中有18个双键
D.C36分子中有12个正五边形,8个正六边形
5.( )下列说法正确的是
A.离子晶体中可能含有共价键,但不一定含有金属元素
B.分子晶体中一定存在分子间作用力,也一定含有共价键
C.非极性分子中一定存在非极性键
D.对于组成结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高
( )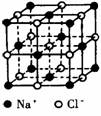 1.纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊性质的原因。假设某纳米材料的大小和形状以及粒子所处的位置恰好与氯化纳晶胞相同(如右图),则这种纳米材料的表面粒子数与总粒子数的比值为
1.纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊性质的原因。假设某纳米材料的大小和形状以及粒子所处的位置恰好与氯化纳晶胞相同(如右图),则这种纳米材料的表面粒子数与总粒子数的比值为
A.26︰27 B.25︰26
C.13︰14 D.7︰8
2.( )AB3是短周期两种元素形成的化合物,已知A原子比B原子多一个电子层,且AB3分子中所有原子满足8电子结构,则下列说法正确的是
A.AB3只能是三氧化硫 B.A可能是ⅢA族元素
C.A可能是ⅤA族元素 D.B的氢化物和A的氢化物都极易溶于水
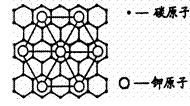 ( )3.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层面料原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见右图,则x值为
( )3.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层面料原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见右图,则x值为
A.8 B.12 C.24 D.60
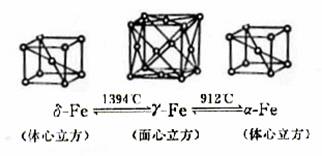 ( )4.铁有δγα三种晶体结构,以下依次是δγα三种晶体不同温度下转化的图示。有关说法不正确的是
( )4.铁有δγα三种晶体结构,以下依次是δγα三种晶体不同温度下转化的图示。有关说法不正确的是
A.δ-Fe晶体中与每个铁原子距离相等且最近的铁原子有8个
B.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有12个
C.如图α-Fe晶胞边长若为a cm,γ-Fe晶胞边长若为bcm,则两种晶体密度比为b3∶a3
D.将铁加热到1500oC分别急速冷却和缓慢冷却,得到的晶体类型相同
15.取2.160g只含一种官能团(非苯环)的某芳香族化合物置于5.000 L氧气中点燃完全燃烧。室温下,测得反应后气体体积减少0.672L,将反应后的气体缓缓通过足量的固体Na2O2后,固体质量增加3.920g。试通过计算说明能否确定该有机物的分子式。若能,试写出其结构简式;若不能,请说明理由。(题中所有数据均已换算为标准状况下)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com