
24.(11分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是.
Mg(OH)2(固) 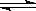 Mg2++2OH-……①
Mg2++2OH-……①
NH4++H2O
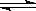 NH3·H2O+H+……②
NH3·H2O+H+……②
H++OH-
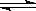 H2O……③
H2O……③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是.
Mg(OH)2(固) 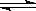 Mg2++2OH-……①
Mg2++2OH-……①
NH4++OH-
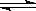 NH3·H2O……②
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是___________(填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由____________________________________
________________________________________________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式__________________________________。
23.(12分)测定海水中溶解氧的步骤如下:(1)水样的固定。取amL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,并振荡摇匀,使之充分反应。(2)酸化。开塞后迅速加适量1:1的硫酸,再迅速塞好瓶塞。反复振荡至沉淀完全溶解。(3)滴定。向溶液中加入1mL0.5%淀粉溶液,再用bmol/LNa2S2O3标准溶液滴定至溶液刚好褪色。有关的离子反应如下:
2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)在进行(1)、(2)操作时,要注意“迅速”,如果操作缓慢,会使测定结果
(填“偏高”或“偏低”或“无影响”)原因是 _ ________________________________________________________________。
(2)滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果
(填“偏高”或“偏低”或“无影响”)原因是 ________________________________________________________________。
(3)滴定前,未排除滴定管中的气泡。在滴定过程中气泡的排除,会使测定结果 ______(填“偏高”或“偏低”或“无影响”)原因是
_____________________________________________________________。
(4)滴定时消耗VmLNa2S2O3标准溶液,则水中溶解O2(g/L)的量的计算式为
____________。
22.(1)(6分) 已知硫酸钡和碳酸钡的Ksp分别为1.1×10-10 mol2·L-2和5.5×10-9 mol2·L-2,用平衡移动理论解释透视用“钡餐”选硫酸钡而不选碳酸钡的理由。
(2)(6分)向50mL0.018mol/L的AgNO3溶液中加入50mL0.020mol/L的盐酸,生成沉淀。如果溶液中c(Ag+)、c(Cl-)乘积一个常数:
即Ksp=1.0×10-10(mol/L)2,试求:
①沉淀生成后溶液中c(Ag+)为 ;②沉淀生成后溶液的PH是 。
21.(8分)有一学生在实验室测某溶液PH。实验时,他先用蒸馏水润湿PH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作是 (填“正确的”或“错误的”)理由是
。
(2)分析该操作是否一定有误差?答
。
(3)若按此法分别测定c(H+)相等的盐酸和醋酸溶液的PH,误差较大的是 ,原因是 。
20.草酸氢钾溶液呈酸性。在0.1mol/LKHC2O4溶液中,下列关系正确的是 ( )
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+ c(C2O42-)=0.1mol/L
C.c(C2O42-)> c(H2C2O4)
D.c(K+)= c(H2C2O4)+c(HC2O4-)+c(C2O42-)
19.向含有Mg2+、Fe2+、NH4+、Al3+的溶液中,加入过量的NaOH溶液,加热并搅拌,再加入过量盐酸,溶液中不减少的阳离子是 ( )
A.NH4+ B.Mg2+ C.Fe2+ D. Al3+
18.下列能说明醋酸是弱酸的事实使 ( )
A.醋酸不易腐蚀衣服。
B.0.1 mol·L-1的CH3COONa溶液的PH约为9。
C.进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多。
D.0.1 mol·L-1的CH3COOH溶液PH约为2.9。
17.下列说法中,正确的是 ( )
A.Na2CO3溶液呈中性 B.K2SO4溶液碱性
C.1.0×10-3mol·L-1的 NaOH溶液pOH=3 D.0.1 mol·L-1的醋酸溶液pH=1
16.下列说法中,正确的是 ( )
A.在任何条件下,纯水都呈中性。
B. 在任何条件下,纯水的pH=7。
C.在95℃时,纯水的pH<7。
D.在95℃时,纯水中c(H+)小于10-7 mol·L-
15.一定量的盐酸跟足量的镁粉反应时,为了减缓化学反应速率,且不影响生成的H2的总量,可向盐酸中加入适量的 ( )
A.NaOH(固) B.NaCl溶液 C.Na2CO3固体 D.Zn粉
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com