
3.铝、铍(Be)及其化合物具有相似的物理、化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓能完全进行,则下列推断中不正确的是
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.Be(OH)2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.虽然BgCl2的水溶液导电性强,但熔融态的BeCl2却不能被电解
2.下列各组热化学方程式(同温、同压下)中Q1大于Q2(Q1、Q2为正值)的有
①:S(g)+O2(g)=SO2(g); ΔH=-Q1kJ/moL
S(s)+O2(g)=SO2(g); ΔH=-Q2kJ/moL
②:C(s)+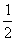 O2(g)=CO(g); ΔH=-QlkJ/moL
O2(g)=CO(g); ΔH=-QlkJ/moL
C(s)+O2(g)=CO2(g); ΔH=-Q2kJ/moL
③:4Al(s)+3O2(g)=2Al2O3(s); ΔH=-QlkJ/moL
4Fe(s)+3O2(g)=2Fe2O3(s); ΔH=-Q2kJ/moL
④:2H2(g)+O2(g)=2H2O(g); ΔH=-QlkJ/moL
2H2(g)+O2(g)=2H2O(l); ΔH=-Q2kJ/moL
A.①② B.③④ C.②④ D.①③
1.下列说法不正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热反应在常温下不一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定的条件下也能发生
26.(11分)已知Cl2在60 ℃的NaOH溶液中能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为5∶2。现将Cl2通入足量的60 ℃的NaOH溶液中,若反应中共有1.5 mol电子发生转移且反应后溶液的体积为500 mL。
(1)写出Cl2在60 ℃的NaOH溶液中符合本题情景的总化学方程式。
(2)计算各生成物(除H2O外)的物质的量浓度。
25.(12分)反应aA(g) +bB(g) cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则
(1)平衡时A与B的转化率之比是_______________。
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b)_______________(c+d) (填“>”“=”“<”或“没关系”)。
(3)设定a=2 ,b=1,c=3,d=2,在甲、乙、丙、丁4个容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是_______________,B的转化率由大到小的顺序是_______________(填容器序号)。
24.(9分)聚氨酯是主链上含有 重复结构单元的一种新型高分子化合物,在高档家具所用低发泡材料方面用途广泛。其单体是异氰酸酯(O==C==N-R-N==C==O)和多元醇(如HO-R′-OH),高聚物结构简式为
(1)由上述异氰酸酯和多元醇合成高聚物的反应类型为_______________。
(2)某聚氨酯类高聚物结构简式为:
它由异氰酸酯A和多元醇B形成,则A和B的结构简式为:
A_______________; B_______________。
23.(10分)某链状酯A的分子式为C6H8O4Cl2,已知1 mol A在酸性条件下水解(假如水解完全)生成2 mol B和l mol C,且A与化合物B、C、D、E的关系如下图所示:
(1)写出C、D、E的结构简式:__________、__________、__________。
(2)写出A与足量NaOH溶液共热的化学方程式:______________________________。
(3)B在NaOH的水溶液中水解后的产物再酸化可得到有机化合物F,F可发生缩聚反应,写出由12个F分子进行聚合,生成链状酯聚合物的化学方程式:____________________。
22.(10分)A-L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物;E的溶液跟石炭酸溶液混合,溶液呈紫色。
A-L各物质之间相互反应转化关系如下图所示:
请回答:
(1)B在A的浓溶液中反应而溶解的条件是__________而常温下B在A的浓溶液中难以反应而溶解的原因是__________________________________________________。
(2)写出下列化学方程式:
F G+A____________________________________________________________;
G F_______________________________________________________________;
E I的离子方程式______________________________________________________。
(3)L转化成I的现象是___________________________________________________。
21.(6分)在周期表的主族元素中,甲元素与乙、丙、丁三元素上下或左右紧密相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数。这四种元素原子的最外层电子数之和为20。据此回答:
(1)甲元素氢化物的电子式为______________________________。
(2)元素乙和丁所形成化合物的分子式为__________或__________。
(3)丙元素最高价氧化物对应的水化物的化学式为__________或__________。
20.(10分)某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水,氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:
2KMnO4+ 16HCl(浓)====2KCl+2MnCl2+5Cl2↑+ 8H2O
(1)装置H中盛放的试剂是______________________。
(2)尾气处理时关闭弹簧夹a和弹簧夹___________,打开弹簧夹___________。
(3)处理尾气时,发生反应的化学方程式是______________________。
(4)用含0.032 mol HCl的浓盐酸跟足量高锰酸钾固体反应,产生氯气的物质的量应___________(填“大于,等于或小于”)0.01 mol 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com