
1.下列反应中生成物总能量高于反应物总能量的是
A.乙醇燃烧 B.碳酸钙受热分解
C.铝粉与氧化铁粉末反应 D.氧化钙溶入水
22.(10分)
将一定量的过氧化钠固体投到一定量的稀硫酸中,待完全反应后,在标准状况下共收集到3.36L的气体,然后将所得溶液蒸干得到不含结晶水的固体36.4g。通过计算回答下列问题[(1)、(2)要有计算过程,(3)只填结果]:
(1)求过氧化钠固体的质量
(2)所得固体的组成和各组份的质量
(3)若加入过氧化钠固体的质量为mg,最后得到固体产物的质量为ng,则n的最大值为____________ (用含m的表达式表示),此时固体的成份是________________。
21.(8分)
进行下列实验:将过量Mg粉溶于100 mL1.5 mol/L.稀H2SO4中,反应结束后,滤去多余Mg粉,滤液在t℃下蒸发,当滤液质量为720g时开始析出MgsO4×H2O晶体,当析出晶体12.3g时,剩下滤液48.0g。通过计算请回答下列问题(请写出计算过程)。
(1)生成标准状况下的气体体积;
(2)开始析出MgSO4·xH2O晶体时溶液的质量分数;
(3)t℃时该晶体的溶解度:
(4)MgSO4·xH2O中的x值。
20.(13分)
下列物质(均为中学化学常见物质)转化关系如图所示,已知D为红棕色粉末(反应条件及部分反应物、产物未全部标出)。
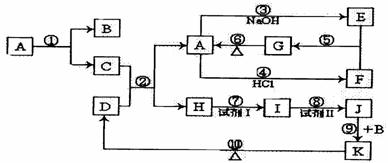
(1)写出下列物质的化学式:
A:___________;B:___________;E:____________;K:___________。
(2)C与D的混合物通常叫做________________ (填名称)。
(3)写出下列反应的化学方程式(注明反应条件,若是离子反应的与离子方程式):
①:__________________________________________________________________;
②:__________________________________________________________________:
③:__________________________________________________________________:
④:__________________________________________________________________。
19.(8分)
已知铁溶于一定浓度的硝酸溶液中反应的离子方程式为(系数a-k均为正整数):aFe+Bno3-+cH+→dFe2++f+fFe3++gNO↑+hN2O↑+kH2O。回答下列问题:
(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是(用一个代数式表示, 下同。)._______________________________;
(2)根据反应中离子的电荷守恒,可得b、c、d、f的关系式是:__________________:
(3)根据反应中电子转移的总数相等,可得d、f、g、h的关系式是:______________:
(4)若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是:__________________。
18.(13分)
已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液呈黄色。
(1)甲同学认为这不是发生化学反应所致,则使溶液呈黄色的物质是:____________ (填粒子的化学式,下同);
乙同学认为这是发生化学反应所致,则使溶液呈黄色的物质是________________。
(2)你认为哪位同学的观点是正确的?______________(填“甲”或“乙”),为了验证你的判断的正确性,请根据下面所提供的可用试剂,用两种方法加以验证,请将选用的试剂代号及实验中观察到的现象填入下表。
实验可供选用试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳
D.硫氰化钾溶液 E.硝酸银溶液 F.碘化钾淀粉溶液
|
实验方案 |
所选用试剂(填代号) |
实验现象 |
|
方案一 |
|
|
|
方案二 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,则首先被氧化的离子是______:
若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行?______,理由是:___________________________________。
(4)在标况下,若向100.0mL溴化亚铁溶液中通入268.8mL的C12时有70%的溴被氧化,则原溴化亚铁溶液的物质的量浓度为____________moL/L。所发生反应的离子方程式为:___________________________________________________________________。
17.(8分)
用固体NaOH配制250mL0.5mol·L-1 NaOH溶液:
(1)在下列仪器中:①托盘天平(带砝码盒):②量筒;③烧杯;④玻璃棒;⑤漏斗; ⑥500mL容量瓶;⑦药匙;⑧250mL容量瓶;⑨胶头滴管;⑩坩埚。
A.配制过程中必需用到的仪器有:_______________________.(填写代号,全对得1 分);
B.容量瓶使用前应________________,中学化学实验常用仪器中使用前和容量瓶使用有相同操作的不同类玻璃仪器还有:_______________,_______________;
(2)下列操作使所配制的NaOH溶液浓度偏高的有:______________(填写代号,每选对一个得1分,选错倒扣分)
①称取固体NaOH时未用小烧杯
②没有用水冲洗烧杯2-3次
③定容时,俯视液面使与刻度相切
④溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度相切
⑤将未冷却的溶液注入容量瓶后,马上定容
⑥样品中混有Na2O杂质
16.将10.5克的Mg、Al、Fe的混合物溶解在200.0mL足量的稀硝酸中,当金属完全溶解后,收集到标况下6.16升的气体,在反应后的溶液中加入5.0 moL/L,的NaOH溶液185.0mL,时沉淀的质量达到最大,则稀硝酸的浓度为
A.1.375mol/L B.4.625mol/L C.6.0mol/L D.无法计算
第Ⅱ卷(共60分)
15.将2molNaHCO3和一定量Na2O2固体混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量n的取值范围是
A.n=l B.l<n<2 C.2≤n<4 D.n≥4
14.下列反应离子方程式正确的是
A.澄清石灰水中加入少量小苏打溶液: Ca2++OH-+HCO3-=CaCO3↓+H2O
B.氯化铁溶液中通入硫化氢气体: 2Fe3++3S2-=2FeS↓+S↓
C.二氧化硫气体通入漂白精溶液中: Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.氯化铝溶液中加入过量氨水:4NH3·H2O+Al3+=4NH4++AlO2-+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com