
5. 据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质。下列说法正确的是
A. 18O2中含18个中子 B. 原子半径:N<18O
C. N5和N2互为同位素 D. 2N5 = 5N2是化学变化
4. NA为阿伏加德罗常数,下列说法中正确的是
A. 17gNH4+中含有的电子数为10NA
B. 1mol·L-1 Mg(NO3)2溶液中含有NO3-的数目为2NA
C. 标准状况下,22.4L甲苯所含的分子数为NA
D. 室温下,28.0g乙烯和丙烯中混合气体中含有的碳原子数为2NA
3.城市环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源,d处在下游有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的
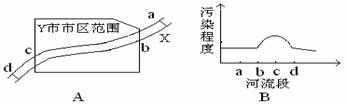
A.造成X河污染的主要污染源最可能分布在bc段
B.工业生活污水、固体废弃物等可能是造成X河污染的污染源
C.该城市建造硫酸厂时,综合考虑诸多因素选址在b处最合理。
D.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致
2. 下列关于碳氢化合物的叙述正确的是
A. 碳氢化合物的通式为CnH2n+2
B. 石油的主要成分是碳氢化合物
C. 碳氢化合物中的化学键都是极性键
D. 乙炔是含碳量最高的碳氢化合物
1.化学与科技、社会、生产密切结合,下列有关说法不正确的是
A.“乙醇汽油”的广泛使用能有效减少有害气体的排放
B.“无磷洗涤剂”的推广使用,能有效减少水体富营养化的发生
C.“无氟冰箱”取代“含氟冰箱”,对人类的保护伞--臭氧层起到保护作用
D.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
25.(6分)
常温下,将22.4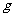
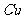 和
和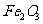 的混合粉末加入足量1
的混合粉末加入足量1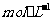 的
的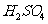 溶液中,反应后溶液的体积为1
溶液中,反应后溶液的体积为1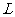 ,测得溶液中
,测得溶液中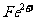 浓度为0.1
浓度为0.1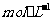 ,求混合物中
,求混合物中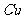 的质量。
的质量。
24.(7分)
甲、乙、丙式三种常见的单质,X、Y、Z是它们的化合物,它们之间有如下图所示的转换关系:
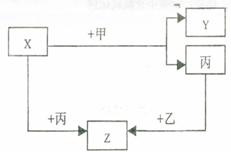
(1)若甲是具有还原性的金属单质,X、Y、Z中有一种是离子晶体,试推断:
①X、Y、Z中含有丙元素的是__________;
②写出Y的电子式__________;
③写出X于甲反应的化学方程式,并标出电子转移的方向和数目:_______________
(2)若甲式具有氧化性的黄绿色气体单质,丙通常式暗红色的液体,Y和Z具有相同的阳离子,X与Z含有相同的阳离子。
①写出乙物质的化学式________;
②写出X与足量的甲在溶液中完全反应的离子方程式:_________
23.(7分)
某芳香族化合物A,A溶液有酸性,向A的溶液中滴入几滴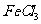 溶液呈紫色,1molA和1mol乙酸再一滴果农条件下反应生成B,B能够被新制的氢氧化铜所氧化。A的相对分子质量不超过130。请回答:
溶液呈紫色,1molA和1mol乙酸再一滴果农条件下反应生成B,B能够被新制的氢氧化铜所氧化。A的相对分子质量不超过130。请回答:
(1)A和B的相对分子质量之差为_______。(2)A的分子式是________。其可能的结构简式为:______________________________。(3)写出B(其中的一种结构即可)被新制氢氧化铜氧化的化学方程式:__________________.1mol最多可能消耗_______mol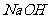 。
。
22.(8分)
实验室中有甲、乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是碳酸钠溶液。为确定甲、乙两瓶溶液的成分及其物质的量浓度,现操作如下:①量取25.00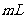 甲溶液,向其中缓缓滴加乙溶液15.00
甲溶液,向其中缓缓滴加乙溶液15.00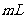 ,共收集到
,共收集到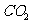 气体224
气体224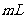 (标准状况)。②量取15.00
(标准状况)。②量取15.00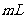 乙溶液,向其中缓缓滴加甲溶液25.00
乙溶液,向其中缓缓滴加甲溶液25.00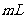 ,共收集到
,共收集到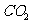 气体112
气体112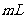 。(标准状况)
。(标准状况)
请回答:
(1)根据上述两种不同操作过程及实验数据可判断甲溶液是__ __,乙溶液是__ _。
(2)用离子方程式表示两次操作得到不同气体体积的原因:
①__________________________;
②_________________________。
(3)甲溶液的物质的量浓度为______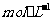 ,(
,(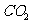 再水溶液中的少量溶解忽略不计)。
再水溶液中的少量溶解忽略不计)。
(4)将n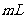 的甲溶液于等体积的乙溶液按各种可能的方式混合,产生的气体体积为V
的甲溶液于等体积的乙溶液按各种可能的方式混合,产生的气体体积为V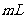 (标准状况),则V的取值范围为____________.
(标准状况),则V的取值范围为____________.
1. 验证乙酰水杨酸中具有羧基和酯的结构(-COOR).
①将一片阿司匹林研啐后溶于水,静置,各取清夜2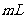 于两支洁净的试管中;
于两支洁净的试管中;
②向一支试管中加入________,若观察到__________,即证明乙酰水杨酸中有羧基;
③向另一支试管加入适量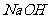 溶液,加热几分钟,冷却后逐滴滴入稀
溶液,加热几分钟,冷却后逐滴滴入稀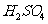 ,再向其中滴入
,再向其中滴入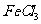 溶液,边加边振荡,若观察到溶液逐渐变为______色,即证明乙酰水杨酸中有酯的结构。
溶液,边加边振荡,若观察到溶液逐渐变为______色,即证明乙酰水杨酸中有酯的结构。
(1) 将上述三处空白补充完整
(2) 实验中滴加稀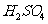 的作用是_____________________ .
的作用是_____________________ .
Ⅱ、该学习小组设计了如下试验方案测定乙酰水杨酸再药片中的含量;
①称取阿司匹林样品m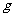 ;
;
②将样品研碎,溶于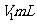 a
a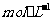
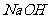 溶液(过量)并加热,出去辅料等不溶物,将所得溶液移入锥形瓶;
溶液(过量)并加热,出去辅料等不溶物,将所得溶液移入锥形瓶;
③向锥形瓶中滴加指示剂,用浓度为b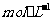 的标准盐酸返滴未反应的
的标准盐酸返滴未反应的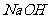 ,消耗盐酸的体积未
,消耗盐酸的体积未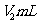 。
。
回答下列问题:
(1)阿司匹林中加入过量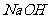 溶液并加热发生反应的化学方程式为:______;其中,加热的目的是__________,
溶液并加热发生反应的化学方程式为:______;其中,加热的目的是__________,
(2)不能将阿司匹林溶解于水后直接用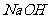 溶液进行滴定的原因是____ _.
溶液进行滴定的原因是____ _.
(3)根据实验中记录的数据,阿司匹林药片中乙酰水杨酸质量分数的表达式为:______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com