
3.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述不正确的是( )
A.氯化硼液态时能导电而固态时不导电 B.氯化硼加到水中使溶液的pH降低
C.氯化硼分子呈正三角形,属非极性分子 D.氯化硼遇水蒸气会产生白雾
2.最近的病毒学家研究发现,一氧化氮对“非典”病毒的抑制作用明显。下列关于NO的说法正确的是( )
A.NO是亚硝酸酐 B.NO只能通过人工合成
C.NO可以是某些含低价态氮元素的物质的氧化产物
D.NO与O2按4∶1体积比混合后与足量的水反应可完全转化为硝酸
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法不正确的是( )
A.“钴酞菁”分子所形成的分散系具有丁达尔效应
B.“钴酞菁”分子既能透过滤纸,也能透过半透膜
C. 此项工作可以用来改变分子的某些物理性质
D. 此工作可广泛应用于光电器件、生物技术等方面
23.(8分)某研究性学习小组进行了甲、乙、丙三组实验:各取30mL相同浓度的NaOH溶液,然后分别缓慢地加入组成相同的硅铝合金粉末(可加热反应),得到下表中有关数据。(假定反应前后溶液的体积不变化,气体体积均在标准状况下测定。已知:
Si+2NaOH+H2O=Na2SiO3+2H2yc↑
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/g |
0.275 |
0.605 |
0.715 |
|
气体体积/mL |
392 |
784 |
784 |
请回答下列问题:
(1)甲组实验中,NaOH溶液 (选填“过量”、“不足”、“适量”)。
(2)合金中硅铝的物质的量之比为 。
(3)计算氢氧化钠溶液的物质的量浓度(列出计算过程)
22. (9分)在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB+(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
(9分)在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB+(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
(1)该反应进行到___ 时达到平衡,用AB表示的平均反应速率为: (分数表示)。
(2)图中对应的a的数值是 ,该反应的化学平衡常数Kc= (保留分数)
温度升高Kc值 (填“增大”、“减少”或“不变”)
(3)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在上图中画出4min~5min的AB浓度的变化线。
(4)在相同条件下,若开始时向此容器中国入的A2(g)、B2(g)和AB(g)的物质的量分别为amol、bmol、cmol,要使达平衡时各物质的体积分数不变,则a、b、c应满足的关系是 (用含a、b、c的代数式表示)。
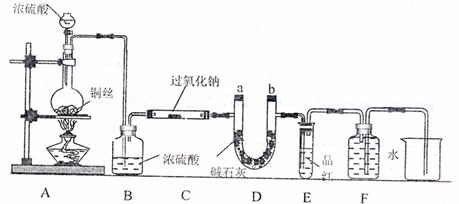 20.(11分)某同学运用已有的Na2O2和CO2反应的知识进行迁移,认为Na2O2也可和SO2反应。为此设计了如下一套装置,来验证Na2O2和SO2反应的反应产物。
20.(11分)某同学运用已有的Na2O2和CO2反应的知识进行迁移,认为Na2O2也可和SO2反应。为此设计了如下一套装置,来验证Na2O2和SO2反应的反应产物。
如图安装仪器,检查装置气密性后 填加药品并滴入适量浓硫酸。回答下列问题:
(1)点燃A处酒精灯,不久可观察到烧瓶中产生大量气体,写出反应的化学方程式:
;C处玻璃管管壁发热,管内药品的颜色变化是 。
(2)在反应过程中如何用较简便的操作证明反应产生了O2?
写出C管内反应的化学方程式,并标出电子转移的方向和数目:
。
(3)F处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?
。
(4)待反应结束后,取C玻璃管内的少量固体,装入试管中,加水溶解时未产生气体,则如何证明产物中有Na2SO3?
。
(5)待反应结束后,取C玻璃管内的少量固体,装入试管中,加入足量的盐酸,再加入氯化钡溶液,发现有白色沉淀生成,试分析产生沉淀的原因:
(6)有的同学认为:若将装置末端的烧杯换成量筒(或量气管),则可通过测定排水的体积来测定Na2O2药品的纯度。试判断该方案是否可行: (填“是”、“否”)原因是 。
21.(9分)已知常温下,AgBr的Ksp=4.9×10-13mol2·L-2、Agl的Ksp=8.3×10-17mol2·L-2。
(1)现向含有AgI的饱和溶液中:
①加入固体AgNO3,则[I-] (填“变大”、“变小”或“不变”,下同);
②若改加更多的AgI,则[Ag+] ;
③若改加AgBr固体,则[I-] ;而[Ag+] 。
(2)有关难溶盐的溶度积及溶解度(与AgBr、AgI无关),有以下叙述,其中正确的是
。
A.两种难熔盐电解质,其中KsP小的溶解度一定小
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶
度积不变,其溶解度也不变。
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该
物质的溶度积。
D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉
淀。
E.难溶盐电解质的Ksp温度有关
F.同离子效应(加入与原电解质具有相同离子的物质),使难溶盐电解质的溶解度
变小,也使Ksp变小。
(3)现向含有NaBr、KI均为0.002mol/L的溶液中加入等体积的浓度为
4×10-3mol/LAgNO3溶液,则产生的沉淀是 (填化学式);若向其中再加入适量的NaI固体,则最终可发生沉淀转化的总反应式表示为:
。
19.(9分)电解原理在化学工业上有着广泛的应用,按下图所示装置进行电解实验:
A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入几滴酚酞试液。
回答下列问题: 工作一段时间后,
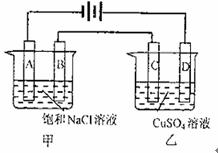
(1)A极附近可观察到的现象是 。
检验B电极上反应产物的通常方法是 。
甲电池中电解反应的离子方程式是 ;
溶液中还可能存在的离子反应方程式是 。
(2)甲槽溶液的pH ;乙槽溶液的pH (填“上升”、“下降”或“不变”)。当A极上收集到22400mL气体(标准状况)时,乙装置的C极上可得到
g金属单质。
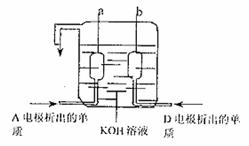
(3)A、D两极上析出的物质可以制成已在阿波罗飞船中使用的新型电源,其结构如右图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出而在电极表面放电。a是电源的 极,电极反应式为 。
18.(8分)
虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用学化方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
①KMnO4+KF+H2O2+HF→K2MnF6+ +H2O
②SbCl5+HF→SbF5+
③2K2MnF6+4SbF5→4KSbF6+2MnF3+F2 ↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为 ,为什么填这一物质,试用氧化还原反应理论解释: 。
(2)完成反应②: 。
(3)反应③中的氧化剂为 ,被氧化的元素为 。
(4)配平反应①,并标出电子转移的方向和数目。(将答案写在下面空格上)
。
17.有200mLMgCl2和AlCl3混合液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L,欲将Mg2+、Al3+恰好转化为沉淀,需加4mol/LNaOH溶液 ( )
A.40mL B.65mL C.72mL D.128mL
第Ⅱ卷(非选择题 共6题,共54分)
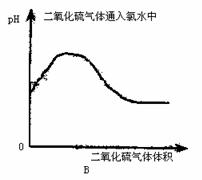
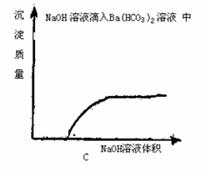
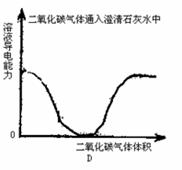
16.下列实验过程中,产生的现象与对应的图象相符合的是 ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com