
5.下列物质能通过化合反应直接制得的是
①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③ C.只有①③④ D.全部
4.下列实验操作或事故处理中,正确的做法是
A.银镜反应实验后附有银的试管,可用稀H2SO4清洗
B.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
C.不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗
D.在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液
3. 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物
B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高
D.1mo1N4气体转变为N2将吸收882kJ热量
2.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02mg/L,下列措施中能够减少SO2排放量的是
①用天然气代替煤炭做民用燃料
②使用水煤气或干馏煤气做燃料
③硫酸厂使用V2O5作催化剂,加快SO2的转化速率
④将块状煤粉碎,提高其燃烧效率
⑤在煤中加入石灰后燃用 ⑥循环处理吸收塔放出的尾气
A.①②③④⑤ B.①③⑤⑥ C.①②⑤⑥ D.②③④⑥
1.《科学》评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中错误的是
A.用膜分离的方法可以使海水淡化
B.高效催化剂可使水分解,同时释放能量
C.密度小于1g/cm3的溶液,浓度越大,密度越小
D.金属的电化腐蚀中,水参与了正极反应
25.(8分)为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确最取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0 g;再另取同样的FeSO4溶液200 mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g。
(1)通过计算,填写下表:
|
c(H+) |
c(SO42-) |
c(Fe2+、Fe3+) |
|
|
|
|
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(2)计算原溶液中Fe2+被氧化的百分率。
(3)当Fe2+部分被氧化时,试推导c(Fe2+、Fe3+)与c(H+)、c(SO42-的关系。
24. (8分) 将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol。(有关反应方程式:①N2O4 2 NO2 ;②2NO2+2NaOH=NaNO2+NaNO3+H2O ;③NO+NO2+2NaOH=2NaNO2+H2O)
(8分) 将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol。(有关反应方程式:①N2O4 2 NO2 ;②2NO2+2NaOH=NaNO2+NaNO3+H2O ;③NO+NO2+2NaOH=2NaNO2+H2O)
(1)若A=0.8,则原0.8mol混合气体能否被烧碱溶液完全吸收?若能,当B=1.0时,原0.8mol混合气体中各气体的物质的量为多少?若不能,该问不用回答。
(2)若仅已知A=0.8,试求B值的范围。
(3)求A=0.8时,气体与碱反应所得溶液中NaNO3的物质的量(可用含有关字母的代数式表示)。
23.(12分)⑴常温下取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合物中下列算式的精确计算结果(填具体数字):
c(Cl-)- c(M+)= mol/L,c(H+)- c(MOH)= mol/L。
⑵如果常温下取0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的PH<7,则说明MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3)弱酸的相对强弱可以用电离常数(K)表示。以HF为例,其电离常数的计算方法是:K=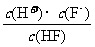 [c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度]。同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样。资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11。回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=
,c(OH-)=
。
[c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度]。同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样。资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11。回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=
,c(OH-)=
。
22.(10分)(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:
 2A(g)+B(g)
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2A(g)+B(g)
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
(1)可根据 现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为 mol,乙中C的转化率 50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度 处(填下列序号)① <6 ② >6 ③ =6。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于 ;若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于 。
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)甲、乙中C的物质的量是 (填:“甲>乙”或“甲<乙”或“甲=乙” );
(2)测得甲中A的转化率为b,则乙中C的转化率为 ;
(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
21.(8分) 下图为某些常见物质之间的转化关系。已知:A、B、I中含有相同的阳离子且都是XY2型化合物,I是常用的干燥剂,C为直线型分子。
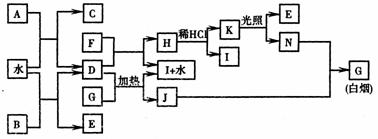
请按要求填空:
(1)B的电子式是 ,K的结构式是 ;
(2)D与G反应的化学方程式是 ;
(3)单质F与D的反应在工业上有重要的用途,其化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com