
17.(12分)下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。

(1) 请在上表中用实线补全元素周期表边界。
(2) 元素③氢化物的电子式为_______。
(3) 元素④-般在化合物中显_______价,但与______形成化合物时,所显示的价态则恰好相反。
(4) 元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系: ____________________。
16.在一定温度下,向一个容积固定的密闭真空容器中充入2molX气体,发生反应:2X(气) ⇌ Y(气)+Z(气),使反应达到平衡,这时容器中的混合气体中X气体的体积分数是a%。若在同一容器中,最初放入的是1mol Y和1mol Z的混合气体。并在相同的温度下使反应达到平衡,这时混合气体中X气体所占的体积分数是b%,则a和b的关系是
A.a > b B.a = b C.a < b D.2a = b
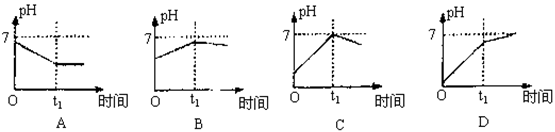
15.已知电解(石墨电极)盐酸、硫酸混合酸时两极生成的气体与时间关系如图所示,则其电解过程中溶液pH随时间变化关系正确的是
14. 实验室用浓盐酸与二氧化锰反应制氯气,下列有
实验室用浓盐酸与二氧化锰反应制氯气,下列有
关说法中正确的是(气体体积在标况下测定)
A.若提供0.4molHCl,MnO2不足,
则可得到氯气2.24L
B.若提供0.4molHCl,MnO2足量,
则可得到氯气2.24L
C.若有0.4molHCl参与反应,则可制得氯气2.24L
D.若有0.4molHCl被氧化,则可制得氯气2.24L
13.下列离子方程式正确的是
A.明矾溶液中加放过量的氨水:Al3+ + 4OH– == AlO2– + 2H2O
B.漂白粉溶液中通入过量的二氧化碳:
Ca2+ + 2ClO– + CO2 + H2O == CaCO3↓+ 2HClO + CO32–
C.FeBr2溶液中加入过量的氯水:2Br– + Cl2 == Br2 + 2Cl–
D.澄清的石灰水中加入过量的NaHCO3溶液:
Ca2+ + 2OH– + 2HCO3– == CaCO3↓+ 2H2O + CO32–
12.如图所示,离子晶体中每个阳离子A或阴离子B,
均被另一种离子以四面体形式包围着,则该晶体
对应的化学式为
A.AB B.A2B C.AB3 D.A2B3
11.下列叙述正确的是
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
 D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线中央
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线中央
10.强酸和强碱稀溶液的中和热可表示为:
H+(aq)+ OH–(aq)= H2O(l);△H = –57.3KJ/mol
已知:CH3COOH(aq)+ NaOH(aq)= CH3COONa(aq)+ H2O(l);△H1
1/2H2SO4(浓)+ NaOH(aq)= 1/2Na2SO4(aq)+ H2O(l);△H2
HNO3(aq)+ KOH(aq)= KNO3(aq)+ H2O(l);△H3
上述反应物除已注明的外均为稀溶液,则△H1、△H2、△H3的关系正确的是
A.△H1 = △H2 = △H3 B.△H1 < △H2 < △H3
C.△H2 < △H3 < △H1 D.△H2 = △H1 < △H3
9. 已知:①向KMnO4晶体滴加浓盐酸,产生黄绿
色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO4– > Cl2 > Fe3+ > I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
8.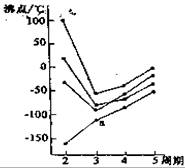 右图中每条折线表示周期表ⅣA-ⅦA中的某一
右图中每条折线表示周期表ⅣA-ⅦA中的某一
族元素氢化物的沸点变化,每个小黑点代表一
种氢化物,其中a点代表的是
A.H2S B.HCl
C.PH3 D.SiH4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com