
6.已知在一绝热容器中,饱和石灰水中存在平衡:Ca(OH)2(s) Ca2++2OH-,现向其中加入少量生石灰,则下列说法错误的是 ( )
Ca2++2OH-,现向其中加入少量生石灰,则下列说法错误的是 ( )
A.析出固体的质量增加 B.溶液中Ca2+的浓度减小
C.溶液中OH-数目减少 D.溶液的pH值不变
5.在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:
A(s)+2B(g)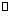 C (g)+D(g) 已达到平衡状态的是 ( )
C (g)+D(g) 已达到平衡状态的是 ( )
①混合气体的压强,②混合气体的密度,③B的物质的量浓度,④气体的总物质的量,
⑤混合气体的平均相对分子质量,⑥v(C)与v(D)的比值
A.②③⑤ B.①②③ C.②③④⑥ D.①③④⑤
4.等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,
下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
3.下列离子反应方程式错误的是 ( )
A.过量的硫化氢通入NaOH溶液 H2S+OH-=HS-+H2O
B.向Ba(OH)2溶液中逐滴加入硫酸氢钠溶液至中性
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.向100mL 0.1mol/L 的FeBr2溶液中通入0.025mol的Cl2
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.碳酸氢镁溶液中加入过量石灰水
Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
2.下列物质中,属于含有极性键的离子晶体是 ( )
A.CH3COOH B.Na2O2 C.NaOH D.MgCl2
1.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是 ( )
A.该元素属于第七周期 B.该元素位于III A族
C.该元素为金属元素,性质与82Pb相似
D.该同位素原子含有114个电子和184个中子
21.(10分)
(1) 8.4g气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态的B2O3和液态水,放出649.5kJ热量,其热化学方程式为______________________________。
(2) X与稀硫酸反应生成无色没有气味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
X与足量稀氢氧化钠溶液反应的离子方程式是_________________________
① 在宇航器中,可以不断的将座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,以除去A。反应的化学方程式是__________________。
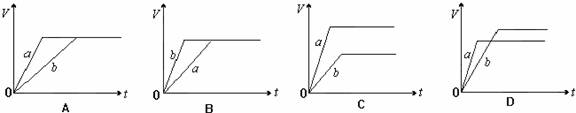
② 熔融碳酸盐燃料电池的工作原理如下图所示:
C (Ⅰ)的电极名称是___________(填正极或负极)。该燃料电池的总反应化学方程式是____________________________________________。
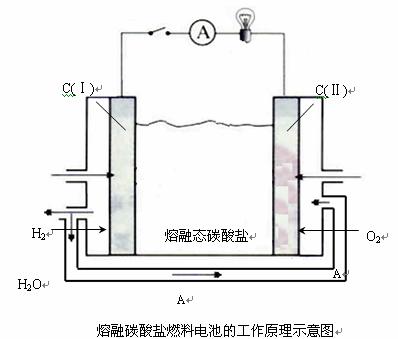
20.(8分)已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为35,A到H是八种常见化合物。上述各物质间的相互关系见下图所示(反应条件省略):
试回答:
(1) 丙的化学式是__________________
(2) 用电子式表示A的形成过程__________________________________
(3) 写出①②两步的化学方程式:
①___________________________________________________________
②___________________________________________________________
19.(10分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A = H+ + HA– HA– ⇌ H+ + A2–
回答下列问题:
(1) Na2A溶液显____________(填“酸性”,“中性”,或“碱性”)。
理由是________________________________________(用离子方程式表示)
(2) 在0.1mol.L–1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A.c(A2–) + c( HA–) + c( H2A) = 0.1mol·L–1
B.c(OH–) = c(H+) + c(HA–)
C.c(Na+ ) + c(H+) = c(OH–) + c( HA–) + 2c(A2–)
D.c(Na+ ) = 2c(A2–) + 2c(HA–)
已知0.1mol·L–1 NaHA溶液的pH = 2,则0.1mol·L–1 H2A溶液中氢离子的物质的量浓度可能是_______0.11 mol·L–1(填“<”,“>”,或“=”),
(3) 0.1mol·L–1 NaHA溶液中各种离子浓度由大到小的顺序是:
________________________________________________________________
18.(12分)
(1) 请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________ + __________ → __________ + __________ + __________ + H2O
(2) 反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3) 反应中1 mol氧化剂_______(填“得到”或“失去”)_________ mol电子。
(4) 请将反应物的化学式及配平后的系数填入下列相应的位置中:
__________ + __________ →
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com